
 .
.分析 A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),则A为H元素,D为Na元素;C与A、B、D均能形成多种常见化合物,可知C为O元素;B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,盐为硝酸铵,可知B为N元素;化合物AE常温下为气体,可知E为H元素,然后结合元素化合物知识来解答.
解答 解:A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),则A为H元素,D为Na元素;C与A、B、D均能形成多种常见化合物,可知C为O元素;B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,盐为硝酸铵,可知B为N元素;化合物AE常温下为气体,可知E为H元素,
(1)非金属性O>N,则氢化物稳定性为H2O>NH3,A与B形成的最简单化合物分子为氨气,含1对孤对电子,3个N-H共价键,其空间构型为 三角锥形,
故答案为:H2O;NH3;三角锥形;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,均显碱性,组成元素的原子数目比均为1:1:1,其中乙是某种家用消毒液的有效成分,则乙为NaClO,甲为NaOH,化合物甲的电子式为 ,
,
故答案为: ;
;
(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1:1,则丙为Na2O2,含有的化学键类型是离子键和共价键(或非极性共价键),
故答案为:离子键和共价键(或非极性共价键);
(4)B元素的最高价氧化物对应的水化物为硝酸,其氢化物为氨气,二者反应生成的盐为硝酸铵,水解呈酸性,用离子方程式解释原因为NH4++H2O?NH3.H2O+H+,
故答案为:酸;NH4++H2O?NH3.H2O+H+;
(5)实验室制取单质E的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子半径、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意化学键、周期律及水解原理的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | H2O分子中H-O的键能为462kJ?mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ?mol-1 | |
| C. | H2的燃烧热为240 kJ?mol-1 | |
| D. | 欲分解2molH2O(l),至少需要提供4×462kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-484kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H(中和热) | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H(中和热) | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H (燃烧热) | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
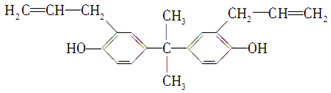
| A. | 该化合物属于芳香烃 | |
| B. | 该化合物与三氯化铁溶液反应显紫色 | |
| C. | 双酚A不能使溴水褪色,但能使酸性高锰酸钾溶液褪色 | |
| D. | 1 mol双酚A最多可与2 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com