
【题目】下表为元素周期表的一部分,其中的编号代表对应的元素。
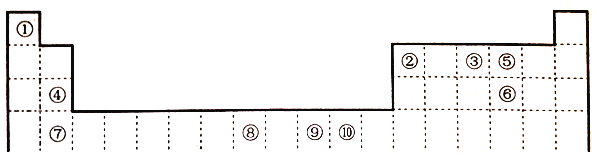
请回答:
(1)在周期表给出的10种元素中,电负性最小的元素基态原子的电子排布式为_____。
(2)在周期表给出的10种元素中,最外层未成对电子数与最外层成对电子数的个数比为3:2的元素与短周期最外层没有未成对电子数的元素形成的化合物是______(填化学式),所含化学键类型是_________。
(3)关于元素①与元素⑤形成的1:1的化合物,下列说法正确的是_____(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1:1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(4)在①与③形成的相对分子质量最小的化合物A中,元素③的杂化类型是_____,写出与化合物A互为等电子体的一种阳离子_______(填离子符号)。
(5)元素⑧的+3价化合物MCl3·6H2O有三种不同颜色的异构体,为探究MCl3溶液析出的暗绿色晶体的化学式,取0.010molMCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870g,该晶体的化学式为_______(填字母序号)。
A.[M(H2O)6]Cl3 B.[M(H2O)5Cl]Cl2·H2O C.[M(H2O)4Cl2]Cl·2H2O
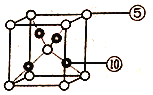
(6)元素⑩与元素⑤形成一种化合物其晶胞结构如下图所示,该化合物的化学式为____,若该晶体密度为dg/cm3,晶胞参数为apm,则阿伏加德罗常数的值NA为______。
【答案】 1s22s22p63s23p64s2 Mg3N2 离子键 C sp3 H3O+ B Cu2O 288×1030/da3
【解析】(1)根据元素在周期表中的位置可知,①②③④⑤⑥⑦⑧⑨⑩分别是H、B、N、Mg、O、S、Ca、Fe、Ni、Cu元素,其中Ca元素金属性最强,则Ca元素电负性最小,Ca为第四周期第IIA族元素,其基态原子的电子排布式为:1s22s22p63s23p64s2。
(2)在H、B、N、Mg、O、S、Ca、Fe、Ni、Cu等10种元素中,最外层未成对电子数与最外层成对电子数的个数比为3:2的元素是N,属于短周期最外层没有未成对电子数的元素是Mg,二者形成的化合物是Mg3N2;Mg3N2是由Mg2+和N3-构成的,所含化学键类型是离子键。
(3)元素①与元素⑤形成的1:1的化合物是H2O2,该化合物中的氢原子满足最外层2电子稳定结构,故A错误;H2O2中只存在共价单键,所以只存在σ键,故B错误;H2O2中氧原子间是非极性键、氢原子和氧原子间是极性键,分子不是直线型的,而是折线型的,正负电荷中心不重合,为极性分子,故C正确、D错误。
(4)H与N形成的相对分子质量最小的化合物是NH3,氨气中价层电子对个数=3+![]() (5-3×1)=4且含有1个孤电子对,所以N原子采用sp3杂化;等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团,所以与化合物NH3互为等电子体的阳离子较多,例如:H3O+、NH4+、Na+、Mg2+、Al3+等。
(5-3×1)=4且含有1个孤电子对,所以N原子采用sp3杂化;等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团,所以与化合物NH3互为等电子体的阳离子较多,例如:H3O+、NH4+、Na+、Mg2+、Al3+等。
(5)由已知0.010mol该物质与足量AgNO3溶液,得到沉淀2.870g,即n(Cl-)=n(AgCl)=2.870g÷0.02mol,所以符合条件的异构体中有2个Cl-(-1价的Cl),根据正负化合价代数和相等可得,该晶体的化学式为[M(H2O)5Cl]Cl2·H2O,故选B。
(6)元素⑩为Cu,元素⑤为O,由二者形成化合物晶胞结构图可得:Cu原子数为4,O原子数为1+8×![]() =2,所以该化合物的化学式为:Cu2O;apm=a×10-10cm,该晶体密度为dg/cm3,则晶胞质量:
=2,所以该化合物的化学式为:Cu2O;apm=a×10-10cm,该晶体密度为dg/cm3,则晶胞质量: ![]() g=dg/cm3×(a×10-10)3cm3,所以NA=288×1030/da3。
g=dg/cm3×(a×10-10)3cm3,所以NA=288×1030/da3。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是


A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4+Al(OH)3
D. C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),②位于元素周期表的第____纵行。
(2)这些元素的最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大的顺序为___________________(用序号表示)。
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同 B.③的简单氢化物比⑥的简单氢化物稳定
C.简单氢化物的沸点:③>⑥ D.③的单质能与⑥的简单氢化物反应生成⑥的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是大气污染物的主要成分。防止空气污染,保卫“兰州蓝”是兰州市一项重要民生工程。利用下图所示装置(电极均为惰性电极)可以吸收SO2还可以用阴极排出的溶液吸收NO2。下列说法错误的是
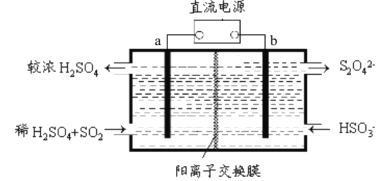
A. 电极a应连接电源的正极
B. 电极b上的电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
C. 反应过程中,H+从a极室流向b极室
D. 每吸收标况下22.4LSO2,在b极室生成2NA个S2O42-
查看答案和解析>>
科目:高中化学 来源: 题型:
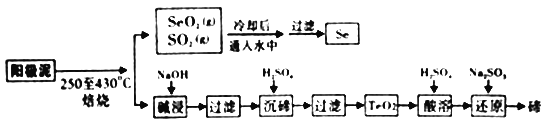
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
已知: (1)TeO2是两性氧化物。
(2)Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)“培烧”时,为提高原料的利用率,可采取的措施有_________(写一条即可)。
(2)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(3)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为______________。
(4)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是______________。
(5)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有10mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),理由是_______________。(已知25℃时,亚硒酸(HSeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.所有主族中都存在非金属元素
B.同周期元素中,第ⅦA族元素的原子半径最大
C.第ⅥA族元素的原子半径越大,越容易得到电子
D.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用电解原理将NO转化为NH4NO3,既节约了资源,又保护了环境。下列有关说法正确的是
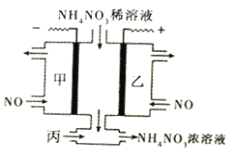
A. NO转化为NH4NO3的反应属于氮的固定
B. 阴极上发生还原反应,电极反应式为:NO+5H++5e-==NH3·H2O
C. 电解池两极上分别生成的甲是NH4+,乙是NO3-
D. 为使电解产物全部转化为NH4NO3,需补充的物质丙为HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( ) 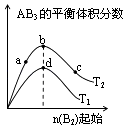
A.图中T2一定大于T1
B.图中b点速率一定大于d点速率
C.达到平衡时,A2的转化率大小为:c>b>a
D.加入催化剂可以使状态d变为状态b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素和化合物的叙述正确的是
A. 组成细胞的元素大多以无机盐的形式存在
B. 单糖是不能水解的糖
C. 细胞中包括糖类、脂肪、蛋白质、核酸在内的有机物都能为细胞生命活动提供能量
D. 胰岛素、蛋白质、脂肪的合成过程中需要供给氮源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com