
 .有机物
.有机物 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 可用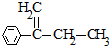 与Cl2在光照条件下通过取代反应获得较纯的该物质 与Cl2在光照条件下通过取代反应获得较纯的该物质 | |
| C. | 在碱性条件下充分水解,可生成羧酸钠 | |
| D. | 在一定条件下可发生聚合反应 |
分析 该有机物中含有苯环、碳碳双键和氯原子,具有苯、烯烃和氯代烃的性质,能发生加成反应、取代反应、氧化反应、加聚反应、水解反应、消去反应等,据此分析解答.
解答 解:A.含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A正确;
B.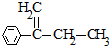 与Cl2在光照条件下发生取代反应时,甲基和亚甲基上的H原子能被氯气取代,所以得不到纯净的
与Cl2在光照条件下发生取代反应时,甲基和亚甲基上的H原子能被氯气取代,所以得不到纯净的 ,故B错误;
,故B错误;
C.该物质发生水解反应生成羧酸,能和氢氧根离子反应生成羧酸盐,故C正确;
D.含有碳碳双键,可以发生加聚反应,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查卤代烃和烯烃性质,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 mol KClO3参加反应,有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应原理 | 实验装置 | 实验步骤 |
(1) (2)  |  | ①在规格为250mL的仪器A中加入一定量的催化剂(易溶于有机溶剂)、适量KMnO4、100mL水; ②安装好仪器,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯; ③控制温度在93℃左右,反应2h,趁热过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩,冷却; ④再次过滤,将滤渣用冷水进行洗涤,干燥后称得其质量为7.19g |
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 属于可溶性盐 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | 碱金属元素是指ⅠA族的所有元素 | |
| D. | 副族元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com