
【题目】按要求填空:
(1)已知下列反应的反应热为:①CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) △H1= - 870.3 kJ mol-1
②C(s)+O2(g) = CO2(g) △H= -393.5 kJ mol-1
③H2(g)+![]() O2(g) = H2O(l) △H= - 285.8 kJ mol-1
O2(g) = H2O(l) △H= - 285.8 kJ mol-1
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g) =CH3COOH(l) △H= _____________。
(2) 已知:2Al (s)+![]() O2(g)= Al2O3(s) △H= -1644.3 kJ mol-1
O2(g)= Al2O3(s) △H= -1644.3 kJ mol-1
2Fe (s) +![]() O2(g)= Fe2O3(s) △H= -815.88 kJ mol-1
O2(g)= Fe2O3(s) △H= -815.88 kJ mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式___________________________。
(3)大气中的部分碘源于O3对海水中Ⅰ-的氧化。将O3持续通入NaI溶液中进行模拟研究 O3将I — 氧化成I2 的过程由3步反应组成: ① I —(aq)+ O3(g)= ⅠO—(aq)+O2(g) △H1
②ⅠO—(aq)+ H+(aq) ![]() HOI (aq) △H2
HOI (aq) △H2
③ HIO(aq) + I—(aq) + H+(aq) ![]() I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的离子方程式为_______________________________ ,反应热为 _______________(用含△H1、△H2、△H3 的式子表示)。
【答案】 △H=-488.3 kJ mol-1 2Al (s)+ Fe2O3(s)= Al2O3(s) + 2Fe (s) △H= -828.42 kJ mol-1 2I —(aq)+ O3(g)+2H+(aq) ![]() I2(aq) + H2O(l) +O2(g) △H1+△H2 +△H3
I2(aq) + H2O(l) +O2(g) △H1+△H2 +△H3
【解析】(1)由盖斯定律可知,2C(s)+2H2(g)+O2(g) =CH3COOH(l)的反应热为②×2+③×2-①,则△H=-393.5 kJ mol-1×2+(- 285.8 kJ mol-1×2)-(- 870.3 kJ mol-1)==-488.3 kJ mol-1;
(2)已知:① 2Al (s)+![]() O2(g)= Al2O3(s) △H= -1644.3 kJ mol-1 ② 2Fe (s) +
O2(g)= Al2O3(s) △H= -1644.3 kJ mol-1 ② 2Fe (s) +![]() O2(g)= Fe2O3(s) △H= -815.88 kJ mol-1,铝粉与氧化铁粉末发生铝热反应的化学方程式:
O2(g)= Fe2O3(s) △H= -815.88 kJ mol-1,铝粉与氧化铁粉末发生铝热反应的化学方程式:
2Al (s)+ Fe2O3(s)= Al2O3(s) + 2Fe (s),此反应的反应热由盖斯定律可知:①-②,
△H=-1644.3 kJ mol-1-(-815.88 kJ mol-1)=-828.42 kJ mol-1,则铝粉与氧化铁粉末发生铝热反应的热化学方程式为:2Al (s)+ Fe2O3(s)= Al2O3(s) + 2Fe (s) △H= -828.42 kJ mol-1;
(3)由已知反应① I —(aq)+ O3(g)= ⅠO—(aq)+O2(g)、②ⅠO—(aq)+ H+(aq) ![]() HOI (aq)、③ HIO(aq) + I—(aq) + H+(aq)
HOI (aq)、③ HIO(aq) + I—(aq) + H+(aq) ![]() I2(aq) + H2O(l),① +② +③ 就得到O3持续通入NaI溶液的离子方程式为:2I —(aq)+ O3(g)+2H+(aq)
I2(aq) + H2O(l),① +② +③ 就得到O3持续通入NaI溶液的离子方程式为:2I —(aq)+ O3(g)+2H+(aq) ![]() I2(aq) + H2O(l) +O2(g),反应热为也为上述三个反应的反应热之和即:△H1+△H2 +△H3。
I2(aq) + H2O(l) +O2(g),反应热为也为上述三个反应的反应热之和即:△H1+△H2 +△H3。


科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中,当下列哪些物理量不再发生变化时,表明A(g) + 2B(g)![]() C(g) + D(g)已达平衡状态:
C(g) + D(g)已达平衡状态:
①混合ν气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量⑤混合气体的平均相对分子质量⑥ν(C)与ν(D)的比值⑦混合气体的总质量⑧混合气体的总体积
A.①③④⑤ B.①②③④⑤⑦
C.①③④⑤⑧ D.①②③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用中,与胶体性质有关的是
A. 向饱和FeCl3溶液中加NaOH溶液,生成红褐色沉淀 B. 食盐调味
C. 十二水硫酸铝钾可以用来净水 D. 海水晒盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是
A. K2SO4=2K++SO4-2 B. Ba(OH)2=Ba2++OH2-
C. Mg(NO3)2=Mg2++2(NO3)2- D. Fe2(SO4)3=2Fe3++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 向小苏打溶液中加入足量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
B. 向醋酸钠溶液中通入少量的二氧化碳:2CH3COO- + CO2 + H2O=2CH3COOH+CO![]()
C. 向溴化亚铁溶液通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D. 向氢氧化钡溶液中加入硫酸氢钠溶液至恰好完全沉淀:Ba2+ +OH-+H++SO42- =BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶质的质量分数为a%、物质的量浓度为c1mol·L-1的稀硫酸加热蒸发掉一定量的水,使质量分数为2a%,此时硫酸的物质的量浓度为c2mol·L-1。已知硫酸浓度越大,密度越大,则c1与c2的数值关系是
A. c1=2c2 B. c2=2cl C. c2>2c1 D. c2<2cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在容积为2.0 L的密闭容器内,物质D在T℃ 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:
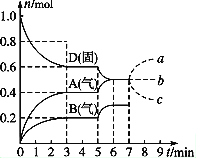
(1)从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为________________。
(2)第5 min时,升高温度,A、B、D的物质的量变化如图,则降温该反应的平衡常数______。(填“增大”“减小”或“不变”)。
(3)若在第7 min时增加D的物质的量,其他条件不变,则A的物质的量图像变化正确的是______________(用图中a、b、c的编号回答)。
II.碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+ I2(g)![]() WI2(g),为模拟上述反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图像[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g),为模拟上述反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图像[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
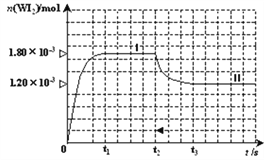
(4)该反应是__________(填写“放热”、“吸热”)反应。在450℃时,该反应的平衡常数K=________。
(5)若t2时温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量______________(填“变大”、“不变”或“变小”)。
(6)若t2时温度不变,向该容器中再加入0.002molW、0.0006molI2、0.0054mol WI2,则化学平衡________________(填“正向移动”、“不移动”或“逆向移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 在托盘天平上放两片大小、质量一样的纸,然后将氢氧化钠放在纸片上称量
B. 把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶
C. 用蒸馏水洗涤烧杯、玻璃棒2—3次,洗涤液也移入容量瓶
D. 沿玻璃棒往容量瓶中加入蒸馏水,到刻度线1—2cm时改用胶头滴管滴加,直到溶液凹液面恰好与刻度线相切
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com