
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1mol SiO2晶体中含有Si-O键的数目为0.2NA
B. 56g铁粉与高温水蒸气反应,生成H2数目为1.5NA
C. 标准状况下,22.4 LCl2溶于水,转移电子数为NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
【答案】D
【解析】
A、根据1mol硅原子形成了4mol硅氧键进行分析;B.铁在高温下与水蒸气反应生成四氧化三铁,四氧化三铁中铁元素的化合价为![]() ;C、氯气溶于水时只有很少一部分氯气和水反应;D、H218O与2H2O的摩尔质量均为20g/mol,且均含10个中子。
;C、氯气溶于水时只有很少一部分氯气和水反应;D、H218O与2H2O的摩尔质量均为20g/mol,且均含10个中子。
A、0.1mol二氧化硅中含有0.1mol硅原子,0.1mol硅原子形成0.4mol硅氧键,晶体中含有Si-O键的个数为0.4NA,选项A错误;B.铁在高温下与水蒸气反应生成四氧化三铁,四氧化三铁中铁元素的化合价为![]() ,0.2mol铁完全反应失去电子数为:0.2mol×(
,0.2mol铁完全反应失去电子数为:0.2mol×(![]() -0)=
-0)=![]() mol,根据电子守恒,生成氢气的物质的量为:
mol,根据电子守恒,生成氢气的物质的量为:![]() =
=![]() mol,生成的H2分子数为
mol,生成的H2分子数为![]() NA,选项B错误;C、氯气溶于水时只有很少一部分氯气和水反应,产生盐酸和次氯酸,所以转移电子数小于NA,选项C错误;D、H218O与2H2O的摩尔质量均为20g/mol,故1.8g混合物的物质的量为0.09mol,且均含10个中子,故0.09mol混合物中含0.9NA个中子,选项D正确;答案选D。
NA,选项B错误;C、氯气溶于水时只有很少一部分氯气和水反应,产生盐酸和次氯酸,所以转移电子数小于NA,选项C错误;D、H218O与2H2O的摩尔质量均为20g/mol,故1.8g混合物的物质的量为0.09mol,且均含10个中子,故0.09mol混合物中含0.9NA个中子,选项D正确;答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)系统命名法命名下列物质
①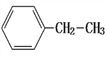 ________;②
________;②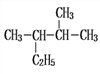 ________;③
________;③![]() ________;
________;
(2)C6H5CH2OH的类别是________,所含官能团的电子式为_________。
(3)已知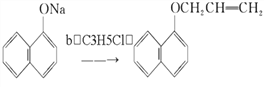 ,试剂b的结构简式为______,b中官能团的名称是________。
,试剂b的结构简式为______,b中官能团的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1mol/LpH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-)
B. 如图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液时,溶液的pH随加入酸体积的变化

C. 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D. pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组研究二价铁的还原性,设计如下实验。
序号 | 实验方案 | 现象 |
Ⅰ |
| 现象a:生成白色沉淀,3 min后沉淀基本变为红褐色 |
Ⅱ |
| 现象b:生成白色沉淀,3 min后沉淀颜色几乎不变 |
(1)实验所用的FeSO4溶液由Fe2(SO4)3溶液和足量铁粉反应制得,离子方程式是____。
(2)实验I中沉淀变为红褐色的化学方程式是________。
(3)关于实验II中白色沉淀的组成,小组同学展开研究。
① 已知Fe(HCO3)2在水中不存在。对沉淀组成作出如下假设,请补充完整。
假设a:依据NaHCO3溶液显_______性,推测白色沉淀可能为Fe(OH)2;
假设b:白色沉淀可能为_______。
② 研究白色沉淀组成的实验如下:
i.取少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
由此说明,白色沉淀中一定含有_________离子。
③ 研究过程中发现白色沉淀在空气中久置,最终变为红褐色。则该沉淀比实验I中所得的Fe(OH)2______(填“难”或“易”)于被空气氧化。
(4)对比实验I,研究酸碱性对二价铁还原性的影响,设计实验III:
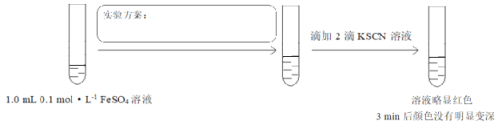
将实验方案补充完整______。
(5)据以上实验,为避免二价铁被空气氧化,可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)化合物N具有镇痛、消炎等药理作用,其合成路线如下:

(1)A的系统命名为____________,E中官能团的名称为____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为____________。
(3)C→D的化学方程式为________________________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应:且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为____________。
(5)F与G的关系为(填序号)____________。
a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
(6)M的结构简式为____________。
(7)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。

该路线中试剂与条件1为____________,X的结构简式为____________;
试剂与条件2为____________,Y的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
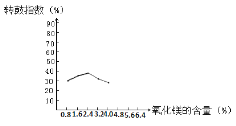
【题目】转鼓指数是反映烧结矿的机械强度的物理性能指标,其值越大,机械强度越好。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
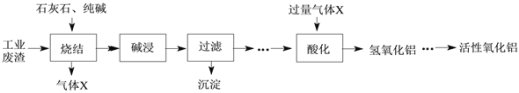
(1)烧结时往往需要加入MgO以提高烧结产物的转鼓指数,下图是转鼓指数与MgO含量的关系曲线。根据此图可知,最适宜的MgO含量是____%。
(2)烧结产物主要有NaAlO2、Ca2SiO4、NaFeO2及气体X。气体X是____。
(3)碱浸前需将烧结产物进行粉碎,其目的是____。碱浸过程中,NaFeO2可与水反应生成NaOH和一种含铁的化合物,该含铁的化合物是____。
(4)酸化时发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2 ,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol∕L的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
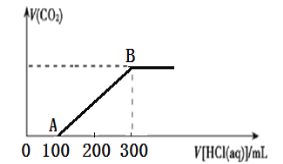
(1)OA段、AB段发生反应的离子方程式:_____________________、___________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是_____________。
(3)原NaOH溶液的物质的量浓度是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列有关说法正确的是
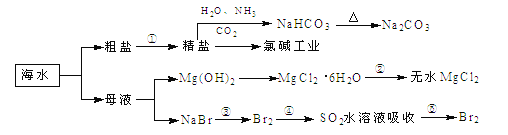
A. 制取NaHCO3的反应是利用其溶解度小于NaCl和NH4Cl
B. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除Ca2+后除SO42-
C. 在工段③、④、⑤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com