
分析 I.化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
Ⅱ.碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为4H2O+2O2+8e-═8OH-,其总反应为CH4+2OH-+2O2=CO32-+3H2O,据此分析解答;
Ⅲ.该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,发生氧化反应的金属Cu作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3为电解质,据此设计原电池.
解答 解:I.在反应N2+3H2?2NH3中,断裂3mol H-H键,1molN三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2molNH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,生成2molNH3放出的热量为:2346kJ-2254kJ=92kJ,故答案为:放出;92;
Ⅱ.碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为4H2O+2O2+8e-═8OH-,其总反应为CH4+2OH-+2O2=CO32-+3H2O,
(1)根据以上分析,该电池的正极为通入氧气的Y极,故答案为:Y;
(2)根据负极反应CH4+10OH--8e-=CO32-+7H2O,当通入5.6L甲烷气体即$\frac{5.6L}{22.4L/mol}$=0.25mol,所以完全反应后有0.25mol×8=2mol电子转移,故答案为:2;
(3)根据反应总反应为CH4+2OH-+2O2=CO32-+3H2O,消耗氢氧根离子,所以该电池的电解质溶液的PH降低,故答案为:降低;
Ⅲ.(1)根据电池反应式知,Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu作负极,不如铜活泼的金属或导电的非金属作正极,如C,FeCl3溶液为电解质溶液,其装置图为 ,故答案为:
,故答案为: ;
;
(2)由方程式可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
点评 本题考查了考查反应热的计算、燃料电池正负极的判断及计算、原电池设计等,把握从键能的角度计算反应热的方法以及原电池原理的应用,注意相关基础知识的积累,题目难度不大.


科目:高中化学 来源: 题型:解答题
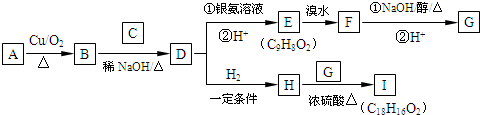
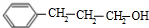 +
+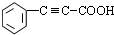 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$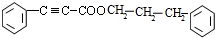 +H2O.
+H2O.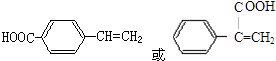 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H2 | C. | C2H4 | D. | C2H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(X)/(mol/L) | 0.10 | 0.10 | 0.20 |
| c(Y)/(mol/L) | 0.15 | 0.18 | 0.30 |
| A. | 反应开始时,甲中反应速率最慢,丙中反应速率最快 | |
| B. | 反应达到平衡时,甲、丙中Q的体积分数相等 | |
| C. | 乙中反应达到平衡时,X的转化率大于60% | |
| D. | 甲中反应达到平衡时,c(Y)=0.10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2晶体中所含离子数约为1.806×1024 | |
| B. | 4.48L氨气分子中含0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | N2H4分子中极性键和非极性键的比值为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,11.2 L己烷含有分子数为0.5NA | |
| B. | 4.2 g乙烯和环丙烷的混合气体含有H原子数为0.6NA | |
| C. | 甲基(-CH3)的电子总数为10NA | |
| D. | 在常温常压下,2.24 L丁烷和2-甲基丙烷的混合气体所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com