
向含有0.03 mol稀H2SO4和0.04 mol稀HNO3的混酸中加入1.92 g Cu,充分反应后得到无色气体(假设反应只有一种还原物),则收集到的气体在标准状况下的体积是多少?
解析: 在溶液中,与Cu反应的H+既有HNO3提供的,也有H2SO4提供的,即n(H+)=0.04 mol+0.03 mol×2=0.1 mol,而n(Cu)=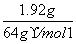 =0.03 mol。3Cu+8H++2NO
=0.03 mol。3Cu+8H++2NO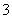 ===3Cu2++2NO↑+4H2O,由方程式所确定的n (Cu)∶n (H+)=3∶8可知,H+过量,所以应按Cu来求NO的量。
===3Cu2++2NO↑+4H2O,由方程式所确定的n (Cu)∶n (H+)=3∶8可知,H+过量,所以应按Cu来求NO的量。
答案: 经分析知铜完全反应,应用铜计算NO的量。设得到NO的物质的量为x,则:
3Cu+8H++2NO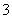 ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
3 2
0.03 mol x
x=0.02 mol。所以VNO标=0.02 mol×22.4 L·mol-1=0.448 L。
即收集到的气体在标准状况下的体积为0.448 L。


科目:高中化学 来源: 题型:
某化学兴趣小组为探究铜与浓硫酸的反应,用如图所示装置进行有关实验。实验中甲同学将a g铜片和12 mL 8 mol·L-1浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。

请回答下列问题:
(1)请写出Cu与浓H2SO4反应的化学方程式:____________。
(2)装置D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是______________________________________________。
实验装置D有可能造成环境污染,试用最简单的方法加以解决(实验用品自选)__________________________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B装置中的现象是____________________________________。
(4)F中应放置的液体是________(填序号)。
A.饱和Na2SO3溶液
B.酸性KMnO4溶液
C.浓溴水
D.饱和NaHSO3溶液
(5)为什么有一定量的余酸,但未能使Cu完全溶解,你认为原因是_____________________________________________________。
(6)下列足量药品能够用来证明反应结束后的烧瓶中确有余酸的是________(填序号)。
A.铁粉 B.BaCl2溶液
C.Ag D.Na2CO3溶液
(7)甲同学向A中反应后的溶液中通入一种气 体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是________(填名称),反应方程式是_____________________________________________。
体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是________(填名称),反应方程式是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是( )。
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以与NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)请将下列物质能够发生的反应填写在下表中。
①由乙烯制氯乙烷
②乙烷与氯气光照
③乙烯使溴的四氯化碳溶液退色
④乙烯通入酸性高锰酸钾溶液
⑤乙烷在空气中燃烧
⑥由苯制取硝基苯
| 反应类型 | 取代反应 | 加成反应 | 氧化反应 |
| 反应 |
(2)甲烷、乙烯、苯三种有机物中具有下列性质的是(填写结构简式)
①在加热的条件下能够与浓硫酸、浓硝酸混合溶液反应,不能使酸性高锰酸钾溶液退色的是________;
②见光能跟氯气反应,不能使酸性高锰酸钾溶液退色的是________;
③在催化剂作用下加氢生成乙烷,加水生成酒精的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是( )
A.浓硝酸使紫色石蕊试液先变红后退色——酸性和强氧化性
B.不能用稀硝酸与锌反应制取氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液红色退去——强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
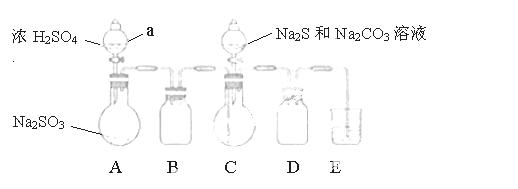
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com