
| A. | 质量数为113 | B. | 质子数为113 | ||
| C. | 相对原子质量为113 | D. | 中子数为113 |
分析 元素符号的左上角所标示的是质量数,左下角标示的是质子数,而质量数=质子数+中子数,据此分析.
解答 解:A、元素符号的左上角所标示的是质量数,故${\;}_{113}^{278}$Nh的质量数为278,故A错误;
B、元素符号的左下角标示的是质子数,故质子数为113,故B正确;
C、一种原子的相对原子质量近似等于其质量数,故${\;}_{113}^{278}$Nh的相对原子质量为278,故C错误;
D、由于质量数=质子数+中子数,故${\;}_{113}^{278}$Nh的中子数=278-113=165,故D错误.
故选B.
点评 本题考查了质量数、中子数和质子数之间的数值关系和原子的相对原子质量的和质量数之间的关系,难度不大,注意基础的掌握和应用.


科目:高中化学 来源: 题型:选择题
| A. | 10℃,5 mL 3% H2O2溶液 | |
| B. | 10℃,5 mL 5% H2O2溶液 | |
| C. | 30℃,5 mL 5% H2O2溶液 | |
| D. | 30℃,5 mL 5% H2O2溶液且加入少量MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
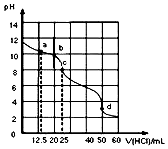 常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )
常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c点:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Na+)=0.1000mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Z>Y | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 元素X和Y只能形成一种化合物 | |
| D. | Y、Z、W的最高价氧化物对应的水化物均能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 向该装置中加入金属Zn和稀硫酸,并关闭活塞,用于检查装置的气密性 | 用该装置制备少量白色的Fe (OH)2沉淀 | 灼烧CuSO4使其分解 | 分离葡萄糖和蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
(1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com