
分析 (1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(N2)=0.5mol,带入v=$\frac{△n}{V•△t}$计算;
(2)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
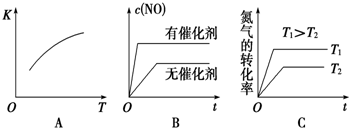
(3)根据温度、催化剂对反应速率和平衡移动的影响判断;
(4)根据化学方程式的特点结合压强对平衡的影响分析;
(5)计算某时刻生成物的浓度幂之积与反应物浓度幂之积的比值,与该温度下的平衡常数相比较,可得出结论.
解答 解:(1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(N2)=0.5mol,v(N2)=$\frac{△n}{V•△t}$=$\frac{0.5mol}{2L×5min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(2)A.消耗1mol N2等效于消耗1mol O2,同时生成1mol O2,故选;
B.混合气体密度一直不变,故不选;
C.混合气体平均相对分子质量不变,总质量是个定值,总物质的量是个定值,混合气体的平均相对分子质量一直不变,故不选;
D.2v(N2)正=v(NO)正=v(NO)逆,故选;
故选:AD;
(3)A、该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,故A正确;
B、加入催化剂,反应速率增大,但平衡不发生移动,故B错误;
C、升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,故C正确;
故答案为:AC;
(4)该反应中,气体的化学计量数之和前后相等,压强对平衡移动没有影响,只要是在相同温度下,则平衡状态相同,与原平衡状态相比,此时平衡混合气中NO的体积分数,故答案为:不变;
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,则有该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为:$\frac{(3×1{0}^{-3}\\;)^{2}}{(2.5×1{0}^{-1})×(4.0×1{0}^{-2})}$=9×10-4<K,则反应应向正反应方向进行,
故答案为:向正反应方向进行;因为浓度商Qc<K.
点评 本题考查化学平衡的有关计算,题目难度中等,注意平衡常数的计算和应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁元素在反应①中被氧化,在③中被还原 | |
| B. | 反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 | |
| C. | 氧化性强弱顺序为:Cl2>I2>Br2>Fe3+ | |
| D. | 还原性强弱顺序为:I->Fe2+>Br->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| C. | 在石油分馏的实验中,需要在蒸馏烧瓶中加入碎瓷片 | |
| D. | 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀时,通常把待镀的金属制品作阳极 | |
| B. | 氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 | |
| C. | 氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-═2H2O | |
| D. | 工业冶炼金属铝的方法是电解熔融的氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的摩尔质量是18 g | |
| B. | 0.012 kg 12C中约含有6.02×1023个碳原子 | |
| C. | 1 mol水中约含有6.02×1023个氢原子 | |
| D. | 1 mol任何物质都含有6.02×1023个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol H2完全燃烧生成液态水时放出571.6kJ的热 | |
| B. | 1 mol H2完全燃烧生成液态水时放出285.8kJ的热 | |
| C. | 2 个H2分子完全燃烧生成液态水时放出571.6kJ的热 | |
| D. | 上述热化学方程式可以表示为:H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,若转移了NA个电子,则阳极质量减少32 g | |
| B. | 1molSiO2中有2NA个硅氧键 | |
| C. | 1 mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目小于NA | |
| D. | 1mol Cl2与过量的铁反应,转移3NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com