
下列顺序不正确的是( )
|
| A. | 热稳定性:HF>HCl>HBr>HI |
|
| B. | 微粒的半径:Cl﹣>Na+>Mg2+>Al3+ |
|
| C. | 电离程度(同温度同浓度溶液中):HCl>CH3COOH>NaHCO3 |
|
| D. | 分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| 元素周期律的作用;弱电解质在水溶液中的电离平衡.. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | A.同主族自上而下元素的非金属性减弱,非金属性越强则氢化物越稳定; B.电子层结构相同核电荷数越大离子半径越小;最外层电子数相等时,电子层数越多,半径越大; C.强电解质的电离程度大于弱电解质的电离程度; D.根据溶液中分散质微粒直径小于1nm,胶体分散质微粒直径介于1~100nm之间,浊液分散质微粒直径大于100nm. |
| 解答: | 解:A.因元素的非金属性越强其对应的氢化物越稳定,非金属性:F>Cl>Br>I,所以热稳定性:HF>HCl>HBr>HI,故A错误; B.因电子层结构相同核电荷数越大离子半径越小,微粒的半径:Na+>Mg2+>Al3+,最外层电子数相等时,电子层数越多,半径越大,微粒的半径:Cl﹣>Na+,所以微粒的半径:Cl﹣>Na+>Mg2+>Al3+,故B正确; C.强电解质的电离程度大于弱电解质的电离程度,HCl=NaHCO3>CH3COOH,故C错误; D.因溶液中分散质微粒直径小于1nm,胶体分散质微粒直径介于1~100nm之间,浊液分散质微粒直径大于100nm,所以分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故D正确; 故选:C. |
| 点评: | 本题主要考查了学生元素周期律、电解质的电离程度、分散系粒子直径大小的比较,可以根据所学知识进行回答,难度不大. |


科目:高中化学 来源: 题型:
下列实验操作中,正确的是( )
A.配制5% NaCl溶液时,将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解
B.配制1 mol·L-1 NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C.配制0.1 mol·L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D.配制1 mol·L-1 Na2CO3溶液500 mL,将Na2CO3放在托盘天平右盘称量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图,下列说法正确的是( )
| X | Y |
| Z | W |
|
| A. | 非金属性:X<Y<Z |
|
| B. | W的原子序数可能是Y的原子序数的2倍 |
|
| C. | 气态氢化物稳定性:Y<W |
|
| D. | Z的化学活泼性一定比X 强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的现象及结论不正确的是( )
|
| A. | 过氧化钠放置在空气中,最终转变为白色粉末Na2CO3 |
|
| B. | SO2通入BaCl2溶液中产生白色沉淀BaSO3 |
|
| C. | 打磨过的铝箔和未打磨的铝箔分别在空气中灼烧,两种铝箔均熔化但不滴落,说明氧化铝熔点比铝高 |
|
| D. | 分别向等物质的量浓度的Na2CO3和NaHCO3溶液中滴加酚酞,溶液都变红,Na2CO3溶液红色较深,说明Na2CO3水解程度大于NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
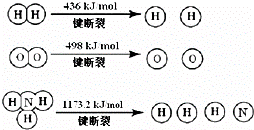
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.
已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol
3H2(g)+N2(g)⇌2NH3(g)△H=﹣92.4kJ/mol
计算断裂1mol N≡N键需要能量 kJ,氮气分子中化学键比氧气分子中的化学键 (填“强”或“弱”),因此氢气与二者反应的条件不同.
(2)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:N2(g)+O2(g)=2NO(g)△H=+180.8kJ/mol,工业合成氨则是人工固氮.分析两种固氮反应的平衡常数,下列结论正确的是 .
| 反应 | 大气固氮 | 工业固氮 |
| |||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10﹣31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:3H2(g)+N2(g)⇌2NH3(g)测得甲容器中H2的转化率为40%.
| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
①判断乙容器中反应进行的方向 .(填“正向”或“逆向”)
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为 .
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
书法离不开文房四宝(笔、墨、纸、砚),做笔用的狼毫、研墨用的墨条、宣纸和做砚台用的砚石的主要成分依次是( )
A.多糖、石墨、蛋白质、无机盐
B.塑料、石墨、多糖、无机盐
C.蛋白质、炭黑、多糖、无机盐
D.蛋白质、煤炭、多糖、有机玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是
A.称量时,将Na2CO3固体直接放在托盘天平的右盘上
B.将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com