
| A. | 乙烯与溴水(加成反应) | B. | 苯与液溴(取代反应) | ||
| C. | 乙醇与乙酸的酯化反应(取代反应) | D. | 乙醇与氧气(取代反应) |
科目:高中化学 来源: 题型:解答题
 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素R位于周期表中第ⅦA族 | |
| B. | RO3-中的R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1 mol RO3-参与该反应,则转移的电子的物质的量为10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 熔点/℃ | 920 | 801 | 1291 | 190 | -107 | 2073 | -57 | 1723 |
| A. | NaCl晶体熔化时,吸收的热量用于破坏离子键 | |
| B. | 表中只有BCl3和干冰是分子晶体 | |
| C. | 碳和硅是同一主族,故CO2和 SiO2的晶体类型相同 | |
| D. | 两种含钠化合物是离子晶体,三种含铝化合物也是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
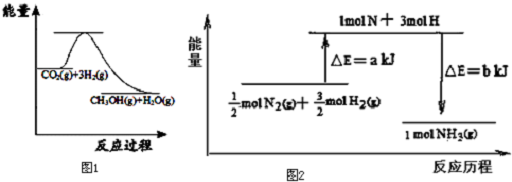
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

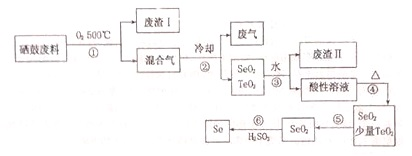
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com