
【题目】NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。实验室制备少量NaClO2的装置如图所示。装置I控制温度在35~55°C,通入SO2将NaClO3还原为ClO2(沸点:11°C)。

回答下列问题:
(1)装置Ⅰ中反应的离子方程式为__________________。
(2)装置Ⅱ中反应的化学方程式为_____________________。
(3)装置用中NaOH溶液的作用是_____________。
(4)用制得的NaClO4/H2O2酸性复合吸收剂同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)和溶液pH对脱硫、脱硝的影响如图所示:

①从图1和图2中可知脱硫、脱硝的最佳条件是n(H2O2)/n(NaClO2)=________________。pH在_________________之间。
②图2中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小。NO去除率减小的可能原因是___________________________________。
【答案】SO2+2ClO3-=2ClO2+SO42- 2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2 吸收尾气,防止污染空气 6:1或6 5.5~6.0 pH>5.5以后,随pH的增大,NO的还原性减弱(或过氧化氢、NaClO2的氧化性减弱),NO不能被氧化成硝酸
【解析】
根据实验目的,装置I为二氧化硫与氯酸钠在酸性条件下反应生成二氧化氯气体,二氧化氯气体在装置II反应生成亚氯酸钠和氧气,二氧化氯有毒,未反应的应进行尾气处理,防止污染环境。
(1)装置Ⅰ中二氧化氯与与氯酸钠在酸性条件下反应生成二氧化氯气体、硫酸钠,离子方程式为SO2+2ClO3-=2ClO2+SO42-;
(2)装置Ⅱ中二氧化氯气体与双氧水、氢氧化钠溶液反应生成亚氯酸钠和氧气,化学方程式为2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2;
(3)二氧化氯有毒,装置用中NaOH溶液的作用为吸收尾气,防止污染空气;
(4)①根据图1而可知,n(H2O2)/n(NaClO2)在6~8时,脱硫、脱硝的去除率几乎无变化,则最佳条件是n(H2O2)/n(NaClO2)=6:1;根据图2可知,pH在5.5时NO的去除率达到峰值,而二氧化硫的去除率已经很高,pH在5.5~6.0时最佳;
②由于NO的去除率在pH>5.5时,随pH的增大,NO的还原性减弱,过氧化氢、NaClO2的氧化性减弱,NO不能被氧化成硝酸,所以去除率减少。


科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:

已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反应类型是_______________。 K中含有的官能团名称是_______________。
(2)E的名称是_______________。
(3)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是__________________。
(4)⑦的化学方程式是______________________________________________。
(5)⑥中还有可能生成分子式为C9H12O2产物。分子式为C9H12O2且符合下列条件的同分异构体共有__________ 种。写出其中两种核磁共振氢谱有5组峰的物质的结构简式_______________________________
a.属于芳香化合物 ,且苯环上只有两个取代基 b.1mol该物质能消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾别名青矾、皂荚矾等,是我国古代常用的药材,以硫铁矿[主要成分为二硫化亚铁(FeS2)]为原料制备绿矾晶体,工艺流程如下:
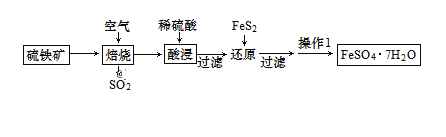
下列说法正确的是
A.焙烧过程中每生成1molSO2转移电子数为5.5NA
B.还原后所得滤液可用高锰酸钾检验Fe3+是否反应完全
C.为中和还原后滤液中过量的酸,可加入一定量FeCO3
D.操作1为蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、M的原子序数依次增大。元素X和铝在元素周期表中具有特殊的“对角线”关系,单质及化合物的性质十分相似;Y原子半径在短周期主族元素中最大;Z元素有多种同素异形体,其中一种为正四面体结构,易自燃;M基态原子未成对电子数在同周期元素中最多。
请回答下列问题:
(1)元素Z在周期表中的位置是_______。
(2)元素X的氧化物能与Y的氧化物的水化物形成的溶液反应,生成一种四配位化合物,写出该化合物的化学式________。
(3)元素Y的氢化物被称作“万能还原剂”,具有强的还原性。其电子式为______,遇水可发生反应的化学方程式为________。
(4)元素M的名称为_______,其+3价氧化物与铝反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
I.氯系消毒剂在生活中有广泛应用。
(1)NaClO2是饮用水的消毒剂,常用FeSO47H2O清除残留的亚氯酸钠。
①Fe2+的电子排布式为[Ar]________________________________。
②与SO42-互为等电子体的分子有____________________(写一种)。
③ClO2-中氯原子的孤电子对数为___________。
④常用K3[Fe(CN)6]检验水中的F2+。K3[Fe(CN)6]的配体是________________。
(2)ClO2是新一代饮用水消毒剂。沸点:ClO2________________(填“>”“<”或“=”)Cl2O,理由是________________________________________________。
Ⅱ.Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。
(2)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:![]()
①有同学书写基态碳原子的核外电子排布图为![]() ,这样的书写不正确,违背了________。
,这样的书写不正确,违背了________。
②乙醛和乙醇的相对分子质量相差2,但是乙醇的沸点远高于乙醛,其主要原因是_______。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子轨道的杂化类型为_______________________。
(3)NO能被FeSO4溶液吸收生成配合物![]() ,该配合物中心离子的配位数为__________________________。
,该配合物中心离子的配位数为__________________________。
(4)研究发现,阳离子的颜色与未成对电子数有关。例如,Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《自然·通讯》(Nature Communications)报道,我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。铜和硒等元素化合物在生产、生活中应用广泛。
请回答下列问题:
(1)基态硒原子的价电子排布式为________;硒所在主族元素的简单氢化物中沸点最低的是________。
(2)电还原法制备甲醇的原理为2CO2+4H2O![]() 2CH3OH+3O2。
2CH3OH+3O2。
①写出该反应中由极性键构成的非极性分子的结构式________;
②标准状况下,V L CO2气体含有________个π键。
(3)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为(π![]() 右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为
右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为![]() ,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
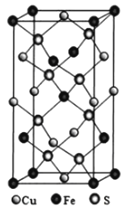
(4)黄铜矿由Cu+、Fe3+、S2-构成,其四方晶系晶胞结构如图所示。则Cu+的配位数为________;若晶胞参数a=b=524pm,c=1032pm,用NA表示阿伏加德罗常数的值,该晶系晶体的密度是________g·cm-3(不必计算或化简,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体在标况下的密度为__________g/L。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于0.1L水中(水的密度:1g·mL-1,且不考虑反应),其溶液中溶质的质量分数为_____。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废钴酸锂电池正极片中(含LiCoO2、Al及少量铁、镁的化合物等)回收钴的工艺流程如下:
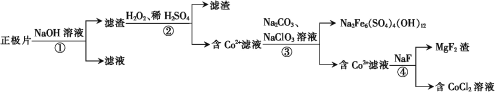
下列叙述错误的是
A.①中发生的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑
B.②中H2O2作还原剂
C.③中Na2CO3可用NaOH代替
D.④中除镁反应不宜在强酸条件下进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com