
| A. | 某烷烃的结构为: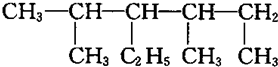 ,正确的命名是3,5-二甲基-4-乙基己烷 ,正确的命名是3,5-二甲基-4-乙基己烷 | |
| B. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| C. | 有机物CH3CH2CH(CH3)2的一氯代物有4种 | |
| D. | 有机同系物具有相同的通式,且组成相差若干个“CH2”,因此等质量的同系物燃烧耗氧相差物质的量为1.5nmol |
分析 A、烷烃命名中依照:长、多、近、小、简原则;
B、明确加聚反应与缩聚反应的区别;
C、有几种化学环境不同的H原子就有几种一氯取代物;
D、甲烷与乙烷为同系物,依据等质量甲烷与乙烷耗氧量判断.
解答 解:A、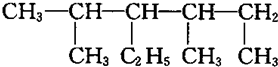 ,该有机物为烷烃,先选取含有碳原子数目最多的碳链为主链,如图划线部分为主链,
,该有机物为烷烃,先选取含有碳原子数目最多的碳链为主链,如图划线部分为主链,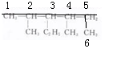 最长碳链含有6个C原子,主链为己烷,编号必须满足支链编号之和最小,从左边编号取代基编号之和最小,在2号C含有1个甲基,在4号C含有1个甲基,3号C含有1个乙基,该有机物命名为:2,4-二甲基-3-乙基己烷,故A错误;
最长碳链含有6个C原子,主链为己烷,编号必须满足支链编号之和最小,从左边编号取代基编号之和最小,在2号C含有1个甲基,在4号C含有1个甲基,3号C含有1个乙基,该有机物命名为:2,4-二甲基-3-乙基己烷,故A错误;
B、聚对苯二甲酸乙二酯属于塑料,不是合成纤维,且是通过缩聚反应得到的,故B错误;
C、有机物CH3CH2CH(CH3)2中含有4种化学环境不同的H,故有4种一氯取代物,故C正确;
D、甲烷与乙烷为同系物,取mg二者,分别燃烧,甲烷耗氧量为0.125mol,乙烷耗氧量为$\frac{3.5mol}{30}$,二者不相差1.5mol,故D错误,故选C.
点评 本题主要考查的是烷烃的命名、合成纤维、同分异构体的判断、烃的燃烧规律等,难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期的所有金属离子中,Y的离子半径最小 |
| Z | Z与Y同周期,是所在周期中原子半径最小的元素 |
| T | T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
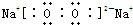 ,该化合物中所含的化学键有离子键、共价键(填化学键名称).
,该化合物中所含的化学键有离子键、共价键(填化学键名称).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li | B. | Ge | C. | P | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaHSO4 | C. | NaHCO3 | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
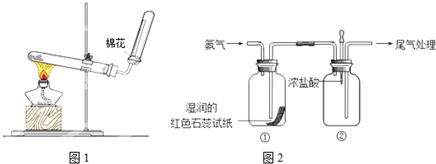
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再改变的状态 | |
| B. | 单位时间生成2n mol C,同时生成n mol D | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | A、B、C、D的分子数之比为1:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
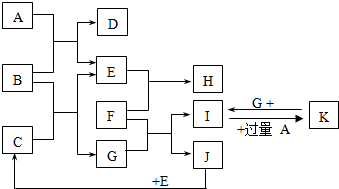 如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质.
如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质.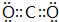 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L (NH4)2SO4溶液中:c(SO42-)<c(NH4+) | |
| B. | 相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH-)之比是2:1 | |
| C. | 向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3-) | |
| D. | 常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com