
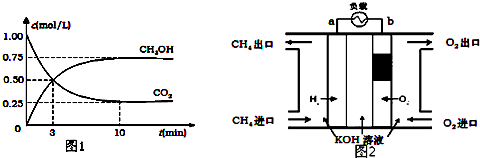
分析 (1)①根据v=$\frac{△c}{△t}$计算;
②根据氢气的平衡浓度判断转化的物质的量,进而可计算转化率;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
④若是恒容密闭容器,加入1mol CH3OH和1mol H2O,虽然逆向移动,平衡移动的结果是减弱这种改变,而不能消除这种改变,即虽然平衡逆向移动,氢气的物质的量基础上增强;
(2)①甲烷燃料电池中,负极上投放燃料甲烷,发生失电子发生氧化反应,正极上投放氧气,发生得电子的还原反应,总反应是燃料和氧气反应的化学方程式;
②根据电池的总反应确定酸碱性的变化;
③根据能量转化情况来回答.
解答 解:(1)①利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225 mol•L-1•min-1,
故答案为:0.225;
②氢气平衡时的物质的量浓度为0.75mol/L,
故答案为:0.75mol/L;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD;
④若是恒容密闭容器,加入1mol CH3OH和1mol H2O,虽然逆向移动,平衡移动的结果是减弱这种改变,而不能消除这种改变,即虽然平衡逆向移动,氢气的物质的量基础上增强,且平衡常数不变达到平衡时H2的物质的量浓度与加氢气之前相比一定增大,故c1<c2,故答案为:<;
(2)①在碱性溶液中,负极上投放燃料甲烷,发生失电子发生氧化反应:CH4-8e-+10OH-═CO32-+7H2O,故答案为:CH4-8e-+10OH-═CO32-+7H2O;
②燃料电池的总反应是:CH4+2O2+2KOH═K2CO3+3H2O,消耗氢氧根离子,所以碱性减弱,pH减小,故答案为:减小;
③甲烷燃烧时要放出热量、光能,所以燃料电池中甲烷的利用率比甲烷燃烧的能量利用率高,故答案为:大于.
点评 本题考查较为综合,涉及热化学、电化学以及化学平衡计算以及平衡移动等问题,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
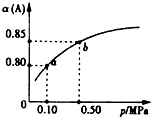 一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )
一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )| A. | 若容器内气体的密度保持不变,说明反应一定达到平衡状态 | |
| B. | 若在相同条件下,改为只加入0.5 mol C,则反应达到平衡反,放出热量Q1kJ | |
| C. | 平衡状态由a变到b时,则化学平衡常数K(a)=K(b) | |
| D. | 由图象可知,产物C一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知 H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则 H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 葡萄糖的燃烧热是2800 kJ•mol-1,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则 2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是 CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1,则 CH3OH(g)的燃烧热为 192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 | |
| C. | 二氧化硅广泛应用于太阳能电池、计算机芯片 | |
| D. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO固体(SiO2),加过量NaOH溶液充分反应,过滤、洗涤、干燥 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水溶解、蒸发、结晶、过滤、洗涤、干燥 | |
| D. | FeCl3溶液(CuCl2),过量铁粉,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯 | B. | 玻璃棒 | C. | 容量瓶 | D. | 分液漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 共价键 | N≡N | H-H | N-H |
| 键能(kJ/mol) | 946 | 436 | 390.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
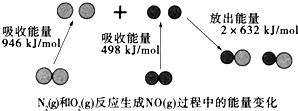
| A. | 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| B. | 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com