
【题目】按要求填空:
(1)在S2、Fe2+、Fe3+、Mg2+、S、I、H+中,只有氧化性的是____________,只有还原性的是____________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是____________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______________。
①2FeCl3+2KI![]() 2FeCl2+2KCl+I2
2FeCl2+2KCl+I2
②2FeCl2+Cl2![]() 2FeCl3
2FeCl3
③2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl与I共存,为了氧化I而Cl不被氧化,除单质外,还应用上述反应中的__________作氧化剂。
【答案】(1)Fe3+、Mg2+、H+ S2、I Fe2+、S
(2)②
(3)KMnO4 FeCl3
【解析】(1)根据元素化合价升降分析判断。元素处于最高价的只有氧化性,故只有氧化性的为Fe3+、Mg2+、H+;元素处于最低价的只有还原性,故只有还原性的是S2、I;中间价态的既有氧化性又有还原性,故既有氧化性又有还原性的是Fe2+、S。
(2)若含有同种元素不同价态的两种物质发生氧化还原反应时,生成物中该元素的价态应介于两种反应物元素价态之间。N元素3价与+2价之间应为0价或+1价,不可能出现+3价的氮,所以②式不能实现。
(3)由①知氧化性:FeCl3>I2,还原性:I>Fe2+;由②知氧化性:Cl2>FeCl3,还原性:Fe2+>Cl;由③知氧化性:KMnO4>Cl2,还原性:Cl>Mn2+,由此推知氧化性强弱顺序为KMnO4>Cl2>FeCl3>I2,还原性强弱顺序为I>Fe2+>Cl>Mn2+。所以KMnO4可氧化Cl、Fe2+及I,FeCl3只氧化I。所以必须选择比Cl2氧化能力差而比I2氧化能力强的氧化剂FeCl3。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中离子浓度关系的表示正确的是( )
A. 在0.1mol·L-1 KHC2O4溶液中:c(K+)+c(H+)=c(HC2O4)+c(OH)+c(C2O42)
B. 0.lmol/L的Na2S溶液中,c(OH-)= c(H+)+ c(HS)+c(H2S)
C. 0.1 mol·L-1的NH4NO3溶液中:c(NO3)>c(H+)>c(NH![]() )>c(OH)
)>c(OH)
D. 物质的量浓度相等的HCOOH和HCOONa溶液等体积混合后的溶液中:2c(Na+)=c(HCOO)+c(HCOOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
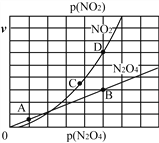
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
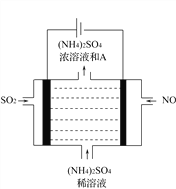
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关以碱金属元素的性质,从上到下递变规律正确的是
A. 金属性逐渐减弱
B. 化合价逐渐升高
C. 失电子能力逐渐增强
D. 最高价氧化物对应的水化物碱性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能通过一步化学反应实现的是( )
A. BaCl2→BaSO4B. CuO→Cu(OH)2
C. NaOH→Na2SO3D. MgSO4→Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是:
A. 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去
B. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C. 已知2SO2(g)+ O2(g)![]() 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和KCl溶液中滴加AgNO3溶液,最先生成Ag2CrO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石与石墨是碳元素的两种结构不同的单质,彼此互称同素异形体。在100 kPa时,1 mol石墨转化为金刚石要吸收1.895 kJ的热能。据此判断在100 kPa压强下,下列说法正确的是
A.金刚石比石墨更稳定
B.石墨比金刚石更稳定
C.1 mol金刚石比1 mol石墨的总能量低
D.1 mol金刚石转变为石墨需要吸收1.895 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
![]()
其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
Ⅰ乳酸的工业生产可以采用生物发酵法,也可以采用有机合成法,其中的一种方法是丙酸法

(1)葡萄糖的结构简式为__________,检验淀粉是否完全水解,可以选用的一种试剂是__________(填序号)。
a.溴水 b.银氨溶液 c.碘酒 d.碘化钾淀粉溶液
(2)丙酸合成法

①反应I的反应类型是___________,进行反应Ⅱ时,需要加入过量乙醇,这样做的目的是________。
②乳酸分子中有一个手性碳原子,通过两种反应可以使A中的手性碳原子失去手性。写出反应的化学方程式_____________________
Ⅱ“皂化值”是使1g 油脂皂化所需要的KOH的毫克数。某单甘油酯的皂化值数为190,通过计算可判断该油脂的名称为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com