
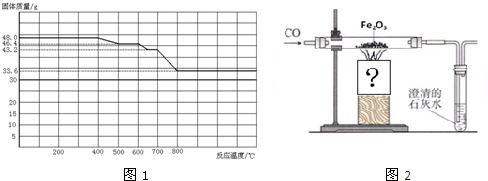
| ||
| ||


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
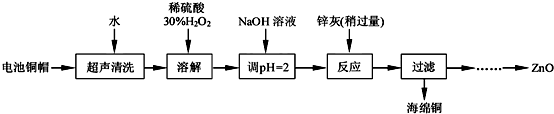
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.0 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将大小、形状相同的镁条和铝条与同浓度、同温度下的盐酸反应时,两者快慢相同 |
| B、盛有相同浓度的双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 |
| C、将浓硝酸分别放在的冷暗处和强光,发现强光下的浓硝酸分解得快 |
| D、将相同浓度Na2S2O2溶液与硫酸溶液混合,升高温度后溶液出现浑浊的时间变短,原因是反应物分子的能量增加,单位体积内活化分子百分数增大,有效碰撞次数增 |
查看答案和解析>>
科目:高中化学 来源: 题型:
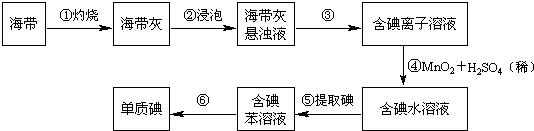
查看答案和解析>>
科目:高中化学 来源: 题型:
| Mg |
| 无水乙醚 |

查看答案和解析>>
科目:高中化学 来源: 题型:

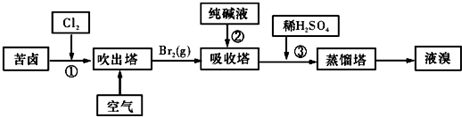
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com