


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
A、氯化钠的电子式为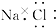 | ||
B、镁的原子结构示意图为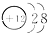 | ||
C、氯化氢分子的形成过程可用电子式表示式: | ||
D、重水的化学式为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
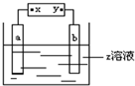 如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板有无色无臭气体放出,符合a极板b极板x电极z溶液的是( )
如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板有无色无臭气体放出,符合a极板b极板x电极z溶液的是( )| A、锌 石墨 负极 CuSO4 |
| B、石墨 石墨 负极 NaOH |
| C、银 铁 正极 AgNO3 |
| D、铜 石墨 负极 CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
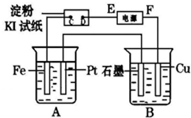 用如图所示的装置进行电解.A中盛有足量CuSO4溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.A中盛有足量CuSO4溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
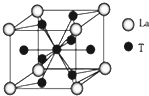 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的d区,且原子序数是d区中最大的.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的d区,且原子序数是d区中最大的.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com