
| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W和Z形成的化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | 由X元素形成的单质不一定是原子晶体 |
分析 X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,最外层电子数平均为5,X与Z可形成XZ2气态分子,X为+4价,Y为-2价,可推出X、Y、Z分别为C、N、O三种元素;Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;W在短周期主族元素中原子半径最大,所以W为Na元素.
解答 解:X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,最外层电子数平均为5,X与Z可形成XZ2气态分子,X为+4价,Y为-2价,可推出X、Y、Z分别为C、N、O三种元素;Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;W在短周期主族元素中原子半径最大,所以W为Na元素.
A.同周期自左向右原子半径减小,同主族自上到下原子半径增大,所有元素中H原子半径最小,故原子半径Na>N>H,即W>Y>M,故A正确;
B.由X、Y、Z、M四种元素形成的化合物可为氨基酸或碳酸铵、醋酸铵等物质,都含有共价键,不一定含有离子键,故B错误;
C.W和Z形成离子化合物为Na2O、Na2O2,阴阳离子个数比都是1:2,故C正确;
D.碳元素单质可以组成金刚石、石墨、C60等,而C60属于分子晶体,故D正确,
故选:B.
点评 本题考查结构性质位置关系应用,综合考查原子结构,元素周期表、元素周期律,分子结构,元素化合物性质等知识,试题难度较大,推断元素是解题关键,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2气态分子是推断的突破口,利用最外层平均电子数,结合XZ2气态分子推断.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②⑤⑥ | C. | ③④ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 | |
| B. | 将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的$\frac{1}{2}$ | |
| C. | 相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 | |
| D. | 甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
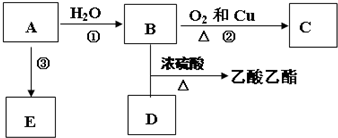
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A. | 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| B. | 甲装置中阴极的反应为Fe-2e-═Fe2+ | |
| C. | 为了增加污水的导电能力,应向污水中如入适量的NaOH溶液 | |
| D. | 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +16.3 | B. | -16.3 | C. | +335.7 | D. | -335.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

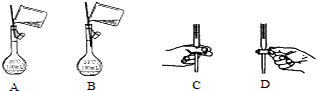
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com