
下列仪器:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常用于物质分离的是( )
| A.①③④ | B.①②⑥ | C.①③⑤ | D.③④⑦ |
科目:高中化学 来源: 题型:单选题
不用其他试剂无法鉴别的一组溶液是
| A.氯化铁溶液和氯化铜溶液 |
| B.硫酸钠溶液和氯化钠溶液 |
| C.氯化铝溶液和氢氧化钠溶液 |
| D.硫酸溶液和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质检验的实验结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体水溶液一定显碱性 |
| D | 将少量某有机物滴加到新制氢氧化铜悬浊液中,充分振荡,未见红色沉淀生成 | 该有机物不含醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用下列装置进行相应实验,能达到目的的是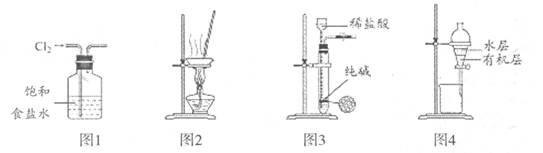
| A.用图1装置除去C12中少量的HCl |
| B.用图2装置蒸干NH4Cl饱和溶液制取NH4Cl晶体 |
| C.用图3装置制取纯净的CO2气体 |
| D.用图4装置分离CCl4萃取碘水后的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
除去下列物质中所含少量杂质(括号内),所选用的试剂和分离方法能达到实验目的的是
| | 混合物 | 试剂 | 分离方法 |
| A | 蔗糖(葡萄糖) | 银氨溶液 | 过滤 |
| B | 甲烷(乙烯) | 溴水 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 淀粉胶体(氯化钠溶液) | 蒸馏水 | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关乙烯和苯燃烧的说法不正确的是
| A.点燃前都要检验纯度 | B.质量相同时,消耗的氧气不同 |
| C.燃烧时都会产生黑烟 | D.充分燃烧,都产生二氧化碳和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为: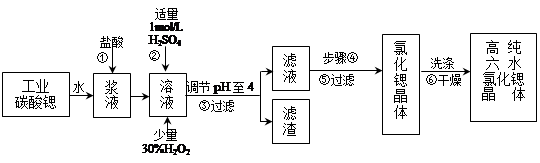
已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO?Cr2O3+8Na2CO3+7O2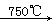 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3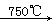 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③Cr2CO72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 ______________ (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是 _______________________ 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、 、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr2O7 + 2KCl=K2Cr2O7 ↓+ 2NaCl,该反应在溶液中能发生的理由是_____________________________。
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列除去杂质的方法,正确的是
| A.苯中含有苯酚杂质:加入溴水,过滤 |
| B.乙醇中含有乙酸杂质:加入碳酸钠溶液,分液 |
| C.FeCl3溶液中含有CuCl2杂质:加入过量铁粉,过滤 |
| D.CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com