
| A.9:2 | B.2:9 | C.9:4 | D.9:1 |
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.c(CH3COO-):③>① |
| B.水电离出的c(OH-):②>① |
C.①和②等体积混合后的溶液: c(OH )=c(H+)+ c(CH3COOH) )=c(H+)+ c(CH3COOH) |
D.①和③等体积混合后的溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH ) ) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
 (填﹥、﹤或=),该混合溶液中离子浓度由大到小的顺序是_____ ___。
(填﹥、﹤或=),该混合溶液中离子浓度由大到小的顺序是_____ ___。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 溶液中,
溶液中, =
= 。现取0.1mol·L
。现取0.1mol·L 溶液与PH=13的
溶液与PH=13的 溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题:
溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题: ___________0.1mol·L
___________0.1mol·L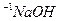 溶液中由水电离出的
溶液中由水电离出的 (填“大于”﹑“小于”或“等于”)。
(填“大于”﹑“小于”或“等于”)。 -
- =_________mol·L
=_________mol·L (用含a的代数式表示)。
(用含a的代数式表示)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1 = Q2 = Q3 | B.2Q3 = Q1 < Q2 | C.Q3 < Q2 < Q1 | D.Q1 < Q2 < 3Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (填序号)。
(填序号)。
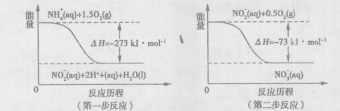
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度的升高,纯水的pH不变 | B.加水稀释,碳酸钠溶液的c(H+)减小 |
| C.温度的升高,硫酸溶液的c(H+)基本不变 | |
| D.pH = 5的盐酸稀释1000倍后,溶液的pH变为8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将醋酸逐滴加入醋酸钠溶液中至溶液呈酸性,则该混合液中: C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| B.将0.1mol/LCH3COOH溶液加水稀释,在此过程中,醋酸的电离程度、溶液的PH都逐渐增大 |
| C.在碳酸氢钠溶液中加入与其等物质的量的烧碱,溶液中的阴离子只有CO3-和OH- |
| D.常温下,将PH==12的烧碱溶液与PH==2的醋酸溶液等体积混合,所得混合溶液的PH>7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com