
| A. | 只有②③④ | B. | 只有②④ | C. | 只有①③④ | D. | 全部 |
科目:高中化学 来源: 题型:选择题
| A. | 31g•mol-1 | B. | 32g•mol-1 | C. | 33g•mol-1 | D. | 17g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
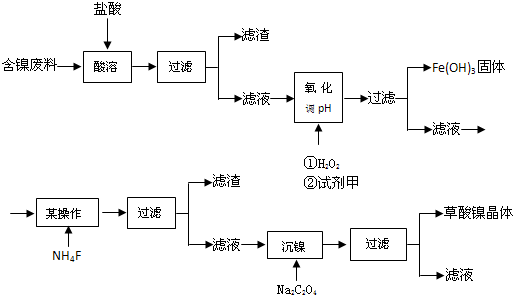
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+与S${\;}_{4}^{2-}$的物质的量浓度之比为2:3 | |
| B. | SO${\;}_{4}^{2-}$的物质的量为0.5mol | |
| C. | 1L溶液中含阴、阳离子共2.5NA个 | |
| D. | 从1L 0.5mol•L-1Al2(SO4)3溶液中取出100mL,Al3+浓度仍为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,写出该的单体的结构简式:CH2=CH2、CH2=CH-CN、C6H5-CH=CH2
,写出该的单体的结构简式:CH2=CH2、CH2=CH-CN、C6H5-CH=CH2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.168升 | B. | 0.14升 | C. | 0.336升 | D. | 0.24升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com