
| A、150mL 2mol?L-1盐酸 |
| B、150mL 2mol?L-1硫酸 |
| C、500mL 3mol?L-1盐酸 |
| D、500mL 18.4mol?L-1硫酸 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、甲、乙 | B、乙、丙 |
| C、丙、丁 | D、乙、丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
233 92 |
A、铀(U)是92号元素,
| ||
| B、Th元素的相对原子质量是231 | ||
| C、232Th转换成233U是化学变化 | ||
| D、230Th和232Th的性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.012 kg 12C中含有约6.02×1023个碳原子 |
| B、1 mol H2O中含有2 mol氢和1 mol氧 |
| C、氢氧化钠的摩尔质量是40 g |
| D、2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
| B、5.6 g铁与足量的稀硝酸反应,失去电子数为0.2NA |
C、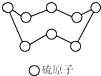 32g硫(结构见图)含S-S的数目为NA 32g硫(结构见图)含S-S的数目为NA |
| D、含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g Fe与足量稀盐酸反应转移的电子数为0.3NA |
| B、常温常压下,23g NO2含有NA个氧原子 |
| C、标准状况下,22.4L水含有个NA H2O分子 |
| D、1mol/L NaCl溶液含有NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com