
 根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.
根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.分析 (1)根据v=$\frac{△c}{△t}$求出氧气的速率,然后根据速率之比等于对应物质的化学计量数之比;
(2)反应放热,为提高SO2平衡转化率,应使平衡向正反应方向移动,可降低温度,体积不变,不能从压强的角度考虑,催化剂不影响平衡移动,移出氧气,平衡向逆反应方向移动,不利于提高SO2平衡转化率,由此分析解答;
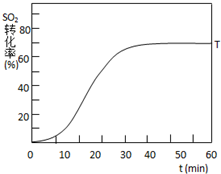
(3)反应是放热反应,温度升高,平衡逆向进行二氧化硫的转化率减小,但达到平衡所需要的时间缩短,据此画出曲线;
(4)①Fe3+与Fe2+易水解,Fe2+易被氧化成Fe3+;
②根据氧化还原反应中的反应物和生成物几何电子守恒来配平化学方程式,结合方程计算转移电子数.
解答 解:(1)v(SO3)=$\frac{△c}{△t}$=$\frac{\frac{0.040mol}{2L}}{2min}$=0.01mol/(L•min),所以v(O2)=$\frac{1}{2}$v(SO3)=0.005mol/(L•min),故答案为:0.005mol/(L•min);
(2)a.移出氧气,平衡逆向移动,二氧化硫的转化率减少,故不选;
b.降低温度,平衡正向移动,二氧化硫的转化率增大,故选;
c.减小压强,平衡逆向移动,转化率减少,故不选;
d.再充入0.050molSO2(g)和0.030molO2(g),相当于增大压强,平衡正向移动,转化率增大,故选;
故选bd;
(3)反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,温度升高,平衡逆向进行,二氧化硫的转化率减小,但反应速率增大,达到平衡需要的时间短,在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图如图所示;
故答案为: ;
;
(4)①Fe2O3(或Fe3O4等)溶于H2SO4后,生成的Fe3+与Fe2+易水解,Fe2+易被氧化成Fe3+,所以要加入Fe粉和酸,抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+,故答案为:抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+;
②-2价的硫离子具有还原性,FeS2可以将溶液中的Fe3+还原为Fe2+,而本身被氧化为硫酸根离子,有关的离子方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,氧化产物是硫酸根离子,有2mol硫酸根生成时转移的电子数为14NA,故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;14NA.
点评 本题考查了化学平衡常数、平衡转化率、影响化学平衡的外界条件综合应用及知识迁移能力等考点,题目难度中等,注意平衡常数在计算中的应用.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | CaO中有少量CaCO3(盐酸) | |
| B. | 氢气中含有少量氯化氢(苛性钠溶液) | |
| C. | 硫酸亚铁溶液中含有少量硫酸铜(铁粉) | |
| D. | CO2中有少量CO(灼热的氧化铜) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 正极的电极反应为Ag2S-2e-═2Ag++S | |
| C. | 该过程中铝是负极,发生氧化反应 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当v(H2)=v(H2O)时,达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})•{c}^{4}({H}_{2}O)}{c(S{O}_{2})•{c}^{2}(NO)•{c}^{4}({H}_{2})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
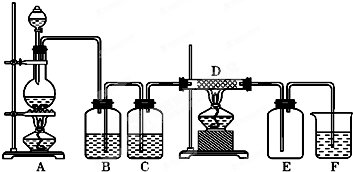 如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.
如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com