
| A. | 钢铁发生电化腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 氢氧燃料电池的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 铜上镀锌时,与电源正极相连的是纯铜 | |
| D. | 用惰性电极电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ |
分析 A.钢铁发生电化学腐蚀时,负极上铁失电子被腐蚀;
B.碱性氢氧燃料电池中,氧气在正极得电子发生还原反应;
C.电镀时,镀层作阳极,镀件作阴极;
D.用惰性电极电解饱和食盐水时,阳极上氯离子放电能力大于氢氧根离子.
解答 解:A.钢铁发生电化学腐蚀时,负极电极反应式为:Fe-2e-═Fe2+,故A错误;
B.碱性氢氧燃料电池中,氧气在正极得电子发生还原反应,电极反应为:O2+2H2O+4e-═4OH-,故B正确;
C.铜上电镀锌时,锌作阳极,阳极(锌)与正极相连,故C错误;
D.用惰性电极电解饱和食盐水时,阴极上是氢离子放电产生氢气,阳极上氯离子放电产生氯气,所以阳极上电极反应式为:2Cl--2e-═Cl2↑,故D错误;
故选B.
点评 本题考查原电池和电解池原理,根据电镀、电解、离子放电顺序来分析解答即可,注意书写电极反应式时要考虑电解质溶液的酸碱性,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 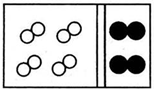 | B. | 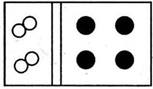 | ||
| C. | 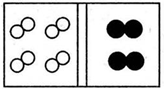 | D. | 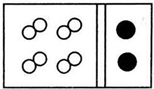 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2 和1molN2 所占的体积都约为22.4L | |
| B. | H2 的气体摩尔体积是22.4L | |
| C. | 标况下1molH2 和1molH2O 所占的体积都约为22.4L | |
| D. | 标况下,22.4LN2 和N2O 组成的混合气体中,所含N原子的物质的量约为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| B. | 将80 g NaOH 溶于1L 水中,所得溶液中NaOH 的物质的量浓度为2mol/L | |
| C. | 18 g 水在标准状况下的体积为22.4 L | |
| D. | 在标准状况下,20 ml NH3与60 ml O2所含的分子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加HCl的浓度 | B. | 加水 | ||
| C. | 增加同浓度盐酸的体积 | D. | 增加压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
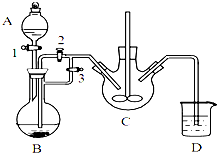 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com