
 (1)现有如下两个反应:
(1)现有如下两个反应:
| ||
| ||
| ||
| ||
| ||
| 11.7g |
| 58.5g/mol |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:江西省白鹭洲中学2011-2012学年高一下学期期中考试化学试题 题型:022
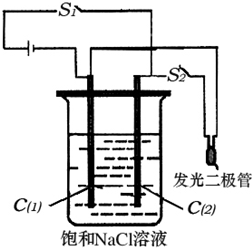
现有如下两个反应:
A.2NaOH+H2SO4=Na2SO4+2H2O
B.CH4+2O2=CO2+2H2O
(1)根据反应的本质,两个反应都为________反应(放热或吸热),判断两个反应
能否设计为原电池?(填“能或不能”)A________B________
(2)如果能,最好应选择________作电解质溶液(NaOH或H2SO4).则负极电极反
应式:________,正极电极反应式:________.(若均不能则此问不填)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com