
【题目】科学家研发出一种太阳光电化学电池(![]() ),可不受限于白天或黑夜全天候地储存电能。该电池以硫酸为电解液,利用太阳能储存电能(充电)的原理如图(图中略去部分光电转换过程),下列说法不正确的是( )。
),可不受限于白天或黑夜全天候地储存电能。该电池以硫酸为电解液,利用太阳能储存电能(充电)的原理如图(图中略去部分光电转换过程),下列说法不正确的是( )。
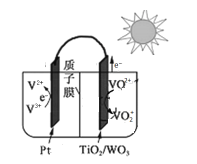
A.放电时,![]() 电极为负极
电极为负极
B.充电时,![]() 通过质子交换膜向
通过质子交换膜向![]() 电极迁移
电极迁移
C.放电时,负极的电极反应式为![]()
D.充电时,![]() /
/![]() 极的电极反应式为
极的电极反应式为![]()
【答案】D
【解析】
由充电示意图中电子的移动方向可知,TiO2/WO3电极为阳极,VO2+在阳极失电子发生氧化反应生成VO2+,电极反应式为VO2++H2O-e-=VO2++2H+,Pt电极为阴极,V3+在阴极得到电子发生还原反应生成V2+,电极反应式为V3++e-= V2+,放电时,TiO2/WO3电极为正极,Pt电极为负极。
A.由分析可知,放电时,Pt电极为原电池的负极,故A正确;
B.充电时,阳离子移向阴极,则氢离子通过质子交换膜向Pt电极迁移,故B正确;
C.放电时,Pt电极为负极,V2+在负极失电子发生氧化反应生成V3+,电极反应式为V2+-e-=V3+,故C正确;
D.电解池的离子交换膜为质子膜,电极反应式不可能有氢氧根离子参与,则充电时,TiO2/WO3电极为阳极,VO2+在阳极失电子发生氧化反应生成VO2+,电极反应式为VO2++H2O-e-=VO2++2H+,故D错误;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下pH为2的盐酸,下列叙述正确的是( )
A.将10mL该溶液稀释至100mL后,pH=4
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1
D.该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。测得溶液pH变化曲线如图,下列说法正确的是( )

A. b点时,c(CO32-)>c(HCO3-)>c(OH-)
B. d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是某甲醇燃料电池的工作示意图。下列说法正确的是

A.电极b为电池的负极
B.电池工作时将电能转化为化学能
C.放电时a极处所发生的电极反应为:CH3OH-6e-+H2O=CO2↑+6H+
D.放电时溶液中H+向a极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由合成气制备二甲醚的主要原理如下。下列有关说法正确的是
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.7 kJ·mol-1
CH3OH(g) ΔH1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
A.将1mol CO(g)和2 mol H2(g)充分反应,反应会放出90.7 kJ能量
B.反应①的ΔS>0
C.反应③使用催化剂,ΔH3减少
D.反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的ΔH=-246.1 kJ·mol-1
CH3OCH3(g)+CO2(g)的ΔH=-246.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1)和S(+6)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
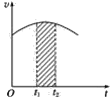
(1)反应开始时反应速率加快的原因是______________。
(2)反应后期反应速率下降的原因是______________。
(3)若纵坐标表示的是某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质的组成、结构有利于更好的理解物质的性质。

⑴图3是As4S4分子的结构,该分子中含非极性共价键的数目是_____;基态As原子的外围电子排布式是______。
⑵图1是某种晶体的晶胞,该晶体的化学式是______。
⑶图1对应物质与图3对应物质熔点较高的是______,原因是______。
⑷NaCl的熔点为801.3℃,MgO的熔点高达2800℃。MgO熔点高的原因是______。
⑸图3所示是硼酸晶体的层状结构,层内H3BO3分子通过氢键相连。H3BO3分子B原子的轨道杂化方式是______,1 mol H3BO3晶体中含有的氢键数目是_____。
⑹金刚石、晶体硅、金刚砂(SiC)的晶体类型相同,它们的熔点由高到低的顺序是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
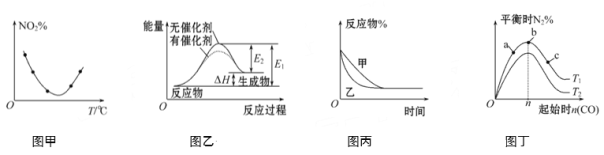
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,则P乙>P甲
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个2 L的真空密闭容器中(预先装入催化剂)通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强是起始时的0.9倍。在此时间段内H2的平均反应速率为0.1 mol·L-1·min-1,则经过时间为( )
A. 2 minB. 3 minC. 4 minD. 5 min
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com