
����Ŀ����ѧ��Ӧԭ���ڻ���������ʵ�������Ź㷺����Ҫ��Ӧ�á�
��.���ú��̷�ˮ(��Ҫ��Mn2����SO![]() ��H����Fe2����Al3����Cu2��)���Ʊ������ܴ��Բ���̼����(MnCO3)������һ�ֹ����������£�
��H����Fe2����Al3����Cu2��)���Ʊ������ܴ��Բ���̼����(MnCO3)������һ�ֹ����������£�
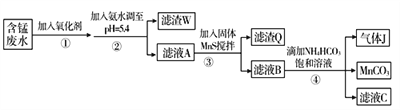
��֪ijЩ������ȫ������pH���±���
������ | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
������ȫʱ��pH | 3.2 | 5.4 | 6.4 | 9.8 | ��0 | ��7 | ��7 |
�ش��������⣺
��1�����̢��У���������W����Ҫ�ɷ���______________________��
��2�����̢��У�������Ӧ�����ӷ���ʽ��______________________��
��3�����̢��У������ɵ�����J��ʹ����ʯ��ˮ����ǣ�������MnCO3�ķ�Ӧ�����ӷ���ʽ��_______________________��
��4����MnCO3���Ƶ���Ҫ�Ĵ���MnO2��2MnCO3��O2===2MnO2��2CO2�����ڿ����м���460.0 g MnCO3���õ�332.0 g��Ʒ������Ʒ������ֻ��MnO����ò�Ʒ��MnO2������������________(�ðٷ�����ʾ��С�������1λС��)��
��.�����£�Ũ�Ⱦ�Ϊ0.1 mol��L��1������������Һ��pH���±���
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN/span> | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
��1����������Һ�е������ӣ����H��������ǿ����_______________________��
��2�����ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01 mol��L��1���������ʵ���Һ�У�������ǿ����________(�����)��
A. HCN�� B. HClO�� C. C6H5OH�� D. CH3COOH E. H2CO3
��.��֪:CO(g)+H2O(g)![]() CO2(g)+H2(g)����H = Q kJ��mol-1��ƽ�ⳣ�����¶ȱ仯���±���ʾ:
CO2(g)+H2(g)����H = Q kJ��mol-1��ƽ�ⳣ�����¶ȱ仯���±���ʾ:
�¶�/�� | 400 | 500 | 850 |
ƽ�ⳣ�� | 9.94 | 9 | 1 |
��ش���������:
��1��������Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ___,�÷�Ӧ��Q____(����>������<��)0��
��2��850 ��ʱ,�����Ϊ10 L�ķ�Ӧ����ͨ��һ������CO��H2O(g),����������Ӧ,CO��H2O(g)��Ũ�ȱ仯��ͼ��ʾ,��0~4 minʱƽ����Ӧ����v(CO)=____��
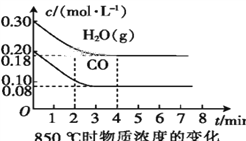
��3������500 ��ʱ����������Ӧ,��CO��H2O(g)����ʼŨ�Ⱦ�Ϊ0.020 mol��L-1,��������,CO�����ת����Ϊ____��
��4������850 ��ʱ����������Ӧ,����ʼʱCO��H2O(g)��Ϊ1 mol,����ˮ�������������Ϊx,ƽ��ʱCO��ת����Ϊy,���Ƶ�y��x�仯�Ĺ�ϵʽ:____��
���𰸡� Fe(OH)3��Al(OH)3 MnS��Cu2��===Mn2����CuS Mn2����2HCO===MnCO3����CO2����H2O 78.6% CO![]() D K=
D K=![]() < 0.03 mol��L-1��min-1 75% y=x
< 0.03 mol��L-1��min-1 75% y=x
����������.(1)���ݱ������ݿ�֪������������ɳ�����pHΪ5.2������������ȫ������pHΪ3.7�����Ե���pH��5.2��Fe2+��Al3+����Fe(OH)3��Al(OH)3����״̬���ڣ��������ijɷ�Ϊ��Fe(OH)3��Al(OH)3���ʴ�Ϊ��Fe(OH)3��Al(OH)3��
(2)CuS��pH��0ʱ��ȫ��������MnS��pH��7ʱ��ȫ���������Լ���MnS��Ϊ��ʹ����Cu2+����CuS������ȥ���ʽ���Ŀ����ʹMnS �� Cu2+���١���ַ�Ӧ����Ӧ�����ӷ���ʽ��MnS+Cu2+=Mn2++CuS�����ʴ�Ϊ��MnS+Cu2+=Mn2++CuS����
(3)���ɵ�����J��ʹ����ʯ��ˮ����ǣ�������Ϊ������̼��Mn2+�ͼ����HCO3-��Ӧ������CO2�����MnCO3��������Ӧ�����ӷ���ʽ��Mn2++2HCO3-=MnCO3+CO2��+H2O���ʴ�Ϊ��Mn2++2HCO3-=MnCO3+CO2��+H2O��
(4)MnCO3���ȷֽ�ΪMnO��MnO��������ΪMnO2����Ʒ��������MnO��460.0 gMnCO3�����ʵ���Ϊ��![]() =4mol�����Ȳ���4molMnO�������MnO2���ʵ���Ϊxmol������xmolMnO������ʣ��MnOΪ(4-x)mol�������������Ϊ��(4-x)mol��71g/mol+xmol��87g/mol=332g�����x=3����MnO2����������=
=4mol�����Ȳ���4molMnO�������MnO2���ʵ���Ϊxmol������xmolMnO������ʣ��MnOΪ(4-x)mol�������������Ϊ��(4-x)mol��71g/mol+xmol��87g/mol=332g�����x=3����MnO2����������=![]() ��100%=78.6%���ʴ�Ϊ��78.6%��
��100%=78.6%���ʴ�Ϊ��78.6%��
��.(1)��ĵ���ƽ�ⳣ��ԽС������ĵ���̶�ԽС���������ˮ��̶�Խ����ͬŨ�ȵ�������Һ��pHԽ�������������Խ������Һ��PH֪��������ǿ�����Ǵ��ᣬ����������̼��������ӣ���������������������CO32-���ʴ�Ϊ��CO32-��
(2)��ĵ���ƽ�ⳣ��Խ����ĵ���̶�Խ�����������Խǿ���������ˮ��̶�ԽС����ͬŨ�ȵ�������Һ��pHԽС������������ǿ���Ǵ���ʴ�Ϊ��D��
��.(1)CO(g)+H2O(g)CO2(g)+H2(g)��ƽ�ⳣ��ΪK=![]() ���ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶�ƽ������Ӧ�ƶ��������¶�ƽ�������ȷ����ƶ���������ӦΪ���ȷ�Ӧ������H=Q��0���ʴ�Ϊ��
���ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶�ƽ������Ӧ�ƶ��������¶�ƽ�������ȷ����ƶ���������ӦΪ���ȷ�Ӧ������H=Q��0���ʴ�Ϊ��![]() ������
������
(2)v(CO)=![]() =0.03mol/(Lmin)���ʴ�Ϊ��0.03mol/(Lmin)��
=0.03mol/(Lmin)���ʴ�Ϊ��0.03mol/(Lmin)��
(3)����ƽ��ʱCO�� ת���������CO��Ũ�ȱ仯��Ϊc����
CO(g)+H2O(g)H2(g)+CO2(g)
��ʼ(mol/L)��0.02 0.02 0 0
ת��(mol/L)�� c c c c
ƽ��(mol/L)��0.02-c 0.02-c c c
500��ʱ��Ӧƽ�ⳣ��K=![]() =9�����c=0.015��CO���������ת����Ϊ��
=9�����c=0.015��CO���������ת����Ϊ��![]() ��100%=75%���ʴ�Ϊ��75%��
��100%=75%���ʴ�Ϊ��75%��
(4)800��ʱ��Ӧƽ�ⳣ��Ϊ1����ʼʱˮ�����ʵ���Ϊxmol��CO�����ʵ���Ϊ (1-x)mol��ƽ��ʱCO��ת����Ϊy����ת����COΪ(1-x)y mol����
CO(g) + H2O(g)H2(g)+CO2(g)
��ʼ(mol)�� 1-x x 0 0
ת��(mol)�� (1-x)y (1-x)y (1-x)y (1-x)y
ƽ��(mol)��(1-x)(1-y) (x-y+xy) (1-x)y (1-x)y
����ƽ�ⳣ��K=![]() =1��������x=y���ʴ�Ϊ��x=y��
=1��������x=y���ʴ�Ϊ��x=y��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3mol��Ȳ��5mol�������ܱ������з�Ӧ������ﵽƽ��ʱ������amol��ϩ����ƽ����������ȫȼ������CO2��H2O���������������ʵ����ǣ�������
A.6mol
B.10mol
C.3amol
D.3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ����������ͺ�����ͬ��ͬѹ�¾�����ͬ�ģ� ��
A.ԭ����B.���C.������D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.ij�������糧��úΪȼ�ϣ��ų��ķ����к���CO2��SO2��ˮ������Ϊ����÷����еijɷ֣�����ͼ��ʾ��װ�ý���ʵ�飺

��1���������ӵ�˳��Ϊ(��ܽӿ���ĸ) ��
��2������ ����֤����CO2��
��3��װ��B�������� ��װ��D�������� ��
II. Ϊ̽��SO2��Ư����SO2ֱ����������ɫ���ʣ�����SO2��ˮ��Ӧ�IJ�������ã������ͼװ�ý���ʵ�飺��ͼ�������������������Ϊ70����
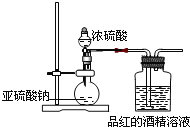
��4������������Ũ���ᷴӦ�Ļ�ѧ����ʽ�� ��
��5��Ϊ̽�������SO2 �ܲ���ʹƷ����ɫ����ָ����Ƶ�ʵ��װ��ͼ���������ԵIJ��㣺
�� ��
�� ��
��6�������ĺ��װ�ã�ʵ���п���SO2�Դ�Լÿ��3�����ݵ��ٶ�ͨ��Ʒ��ľƾ���Һʱ������һСʱ��Ʒ���Բ���ɫ����˵��Ʒ����ɫ��ԭ����SO2ֱ�ӵ��¡����ԣ�SO2 ͨ��Ʒ��ˮ��Һ������Ʒ����ɫ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����(�� ��)
A. ̼��������Һ����������ʯ��ˮ��Ӧ��HC![]() +Ca2++OH��CaCO3��+H2O
+Ca2++OH��CaCO3��+H2O
B. �Ȼ������������������Һ��ϼ��ȣ�N![]() +OH��
+OH��![]() H2O+NH3��
H2O+NH3��
C. �ƺ���ˮ��Ӧ��Na��2H2ONa+��2OH����H2��
D. ���Ȼ�����Һ�еμӹ�����ˮ��Al3++3OH��Al(OH)3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ڱ���ǰ�����ڵ�����Ԫ��A��B��C��D��E��F�˵����������������Aԭ�Ӻ���������δ�ɶԵ��ӣ�������B2E�ľ���Ϊ���Ӿ��壬Eԭ�Ӻ����M���������ԳɶԵ��ӣ�CԪ���ǵ��к�����ߵĽ���Ԫ�أ�D���ʵ��۵���ͬ����Ԫ���γɵĵ���������ߵģ�F2�����Ӻ��������Ӿ������������������Ϣ���ش��������⣺
��1��A��B��C��D�ĵ�һ��������С�����˳��Ϊ______����Ԫ�ط��ű�ʾ��
��2��B���Ȼ�����۵��D���Ȼ�����۵�ߣ�������______��
��3��E�������������ӵĿռ乹����______����______���ӣ�����ԡ����Ǽ��ԡ���
��4��Fԭ�ӵļ۲�����Ų�ʽ��_____��
��5��E��F�γ�ij�ֻ���������ͼ��ʾ���־���ṹ����ɫ���ʾFԭ�ӣ����仯ѧʽΪ_____����a����Eԭ�ӵ���λ��Ϊ______�����ڣ�b���Ľṹ��ȡ��һ��ƽ����������Ϊ��������ƽ��һ�������к���_____��Fԭ�ӡ��ṹ��a���루b���о�����ԭ�ӿռ���������ȣ���a��________��b�����>����<����=����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������ᷢչϢϢ��أ�����˵������ȷ����
A.�����������Ѽ�·�������������γɵ����ܽ��ж����ЧӦ
B.������һ�գ���ˮ�����գ���ȡ֭����ʫ���������϶������ص���ȡ���ڻ�ѧ�仯
C.����������������֮�Ϊͭ�����ù��̷������û���Ӧ
D.�����ϵ���˿����������ɻ���ʼ���� ʫ�����漰������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.���������ڴ�����Һ��C6H5O��+H+��C6H5OH
B.��ϡ�����ȥ�Թ��ڱ�����Ag+2H++NO3���TAg++NO2��+H2O
C.����ˮ�ⷴӦ��CH3CH2OOCCH3+H218O ![]() CH3CH2OH+CH3CO18OH
CH3CH2OH+CH3CO18OH
D.��ȩ��������Ӧ��CH3CHO+2Ag��NH3��2OH ![]() CH3COO��+NH4++2Ag��+3NH3+H2O
CH3COO��+NH4++2Ag��+3NH3+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NO3�������Ի���������¾��ɷ�Ӧ���ش��������⣺
��1��Ϊ�˽�������ˮ��NO3����Ũ�ȣ������ڼ��������������۽�NO3����ԭΪN2�����Ʋ���ƽ�÷�Ӧ��__Al +___NO3�� + ___OH�� = ____________+ ____N2�� + ____H2O��ÿ����1mol NO3����ת�Ƶĵ�����ĿΪ_____��
��2��ijͬѧȡһ�������������Ͻ���100mLxmol/Lϡ�����ַ�Ӧ����Ӧ������û������ų����ڷ�Ӧ���������Һ�У���μ���4 mol/L NaOH��Һ������NaOH��Һ�����(mL)��������������ʵ���(mol)�Ĺ�ϵ��ͼ��ʾ��

��д��EF�η�����Ӧ�����ӷ���ʽ_________________________________________��
�� C���Ӧ����Һ�к��е������ӳ�Na+�⣬������___________________________��
�� x=_________��
�������Ͻ����������ʵ�������Ϊ______________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com