
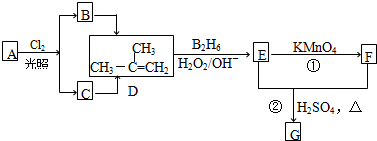
| ||
| H2O2/OH- |
| 11.2L |
| 22.4L/mol |
| 88g |
| 44g/mol |
| 45g |
| 18g/mol |
| 2mol |
| 0.5mol |
| 2.5mol×2 |
| 0.5mol |
| 11.2L |
| 22.4L/mol |
| 88g |
| 44g/mol |
| 45g |
| 18g/mol |
| 2mol |
| 0.5mol |
| 2.5mol×2 |
| 0.5mol |
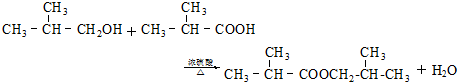 ,
,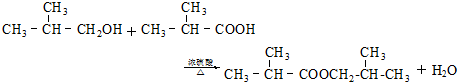 ;
;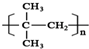 ,
, .
.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、③④ |
| C、①② | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素原子中,3d、4s电子的能量逐渐升高 |
| B、该元素位于周期表ds区 |
| C、该元素在元素周期表中的位置为第四周期IIIB族 |
| D、该元素原子最外层有3个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
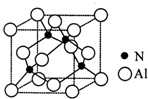 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
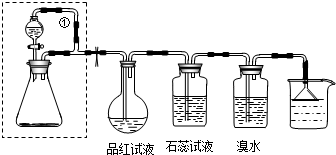
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com