
【题目】多尺度复杂化学系统模型可以用量子化学计算小区间内(如生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①乙炔是__________(填“非极性”或“极性”)分子。
②碳负离子CH3-的立体构型为____________。
③根据等电子原理,NO+的电子式为________________。
(2)钒可用于合成电池电极,也可用于人工合成二价的钒固氮酶(结构如图a)。
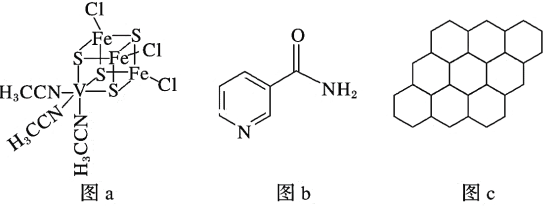
①V2+基态时核外电子排布式为____________________________________________。
②钒固氮酶中钒的配位原子有_____________________________(填元素符号)。
(3)烟酰胺(结构如图b)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有_______________________,1 mol该分子中含σ键的数目为________。
(4)12 g石墨烯(结构如图c)中含有的正六边形数目约为________;请你预测硅是否容易形成类似石墨烯的结构,并说明理由:___________________________________。
【答案】非极性 三角锥形 ![]() 1s22s22p63s23p63d3(或[Ar]3d3) S、N sp2、sp3 15NA 0.5NA 不容易,硅原子半径大,3p轨道不易形成π键
1s22s22p63s23p63d3(或[Ar]3d3) S、N sp2、sp3 15NA 0.5NA 不容易,硅原子半径大,3p轨道不易形成π键
【解析】
(1)①乙炔是为直线型对称结构,分子中正负电荷重心重合;
②计算CH3-离子中C原子价层电子对数、孤电子对数,进而确定其空间构型;
③等电子体结构相似,NO+与氮气互为等电子体;
(2)①V元素原子核外电子数为23,失去4s2上2个电子形成V2+;
②配位原子提供孤对电子;
(3)根据N原子价层电子对数,确定N原子杂化方式;单键为σ键,双键含有1个σ键、1个π键,注意C的四价结构;
(4)由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形含有6×![]() =2,计算12石墨烯中碳原子数目,进而计算含有的正六边形数目;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键。
=2,计算12石墨烯中碳原子数目,进而计算含有的正六边形数目;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键。
(1)①乙炔是为直线型对称结构,分子中正负电荷重心重合,属于非极性分子;
②CH3-离子中C原子价层电子对数为3+![]() =4,含有1对孤电子对数,其空间构型为三角锥形;
=4,含有1对孤电子对数,其空间构型为三角锥形;
③NO+与氮气互为等电子体,NO+中N原子与O原子之间形成3对共用电子对,其电子式为![]() ;
;
(2)①V元素原子核外电子数为23,失去4s2上2个电子形成V2+,则V2+基态时核外电子排布式为1s22s22p63s23p63d3(或[Ar]3d3);
②由图可知,N和S提供孤对电子,则钒固氨酶中钒的配位原子是S与N;
(3)由烟酰胺结构式可知,分子中氨基中N原子成3个σ键、含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,而环中N原子成2个σ键、含有1对孤电子对,杂化轨道数目为3,采取sp2杂化;分子中含有4个C-H键、2个N-H键、3个C-C键、2个C-N键、4个双键,其中单键均为σ键,双键含有1个σ键、1个π键,则每个分子中含有15个σ键,故lmol该分子中含σ键数目为15NA;
(4)12g石墨烯中碳原子的物质的量为![]() =1mol,由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形平均含有碳原子数为6×
=1mol,由石墨烯的结构图可知,每个碳原子为3个正六边形共有,则一个正六边形平均含有碳原子数为6×![]() =2,则一共含有的正六边形数目为1mol×
=2,则一共含有的正六边形数目为1mol×![]() ×NAmol-1=0.5NA;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键,硅不容易形成类似石墨烯的结构。
×NAmol-1=0.5NA;Si原子半径比碳原子半径大,3p轨道不易重叠形成π键,硅不容易形成类似石墨烯的结构。


科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1807年,英国化学家戴维在研究中发现:电解条件下可把水分解成H2和O2。他设想用电解的方法从KOH、NaOH中分离出K和Na。最初,戴维用饱和KOH溶液进行电解,不料还是得到H2和O2。这时,他考虑在无水条件下继续这项实验,但是,实验中产生的金属液珠一接触空气就立即燃烧起来;这时,他又考虑在________条件下电解熔融的KOH继续实验,最后他终于成功地得到了银白色的金属钾。
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料回答下列问题:
Ⅰ.铷位于元素周期表的第________周期________族。
Ⅱ.关于铷的下列说法中正确的是________(填序号,下同)。
①与水反应比钠更剧烈 ②Rb2O在空气中易吸收水和二氧化碳 ③Rb2O2与水能剧烈反应并释放出O2④它是极强的还原剂 ⑤RbOH的碱性比同浓度的NaOH弱
Ⅲ.现有铷和另一种碱金属形成的合金5g,与足量水反应时生成标准状况下的气体2.24 L,则另一碱金属可能是________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)热分解法制氢。某温度,H2O(g) ![]() H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
(2)热化学循环制氢。制备H2的反应步骤如下:
①Br2(g) + CaO(s) = CaBr2(s) + 1/2O2(g) ΔH=-73 kJ·mol-1
②3FeBr2(s) + 4H2O(g) = Fe3O4(s) + 6HBr(g) + H2(g) ΔH=+384 kJ·mol-1
③CaBr2(s) + H2O (g) = CaO(s) + 2HBr(g) ΔH=+212 kJ·mol-1
④Fe3O4(s)+8 HBr(g) = Br2(g) + 3FeBr2(s) + 4H2O(g) ΔH=-274 kJ·mol-1
则 H2O(g) ![]() H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
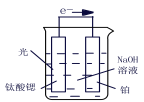
(3)光电化学分解制氢,钛酸锶光电极:4OH--4e- ![]() O2+2H2O,则铂电极的电极反应为_______。
O2+2H2O,则铂电极的电极反应为_______。
(4)水煤气法制氢。CO(g) + H2O(g) ![]() CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
① 若升高温度到950℃时,达到平衡时K_________1(填“>”、“<”或 “=”)。
② 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(5)甲烷制氢。将1.0 mol CH4和2.0 mol H2O (g)通入容积为100 L的反应室,在一定条件下发生反应:CH4(g) + H2O (g)=CO (g) + 3H2(g)。测得达到平衡所需的时间为5 min,CH4的平衡转化率为50%,则用H2表示该反应的平均反应速率为_____。
(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质。该反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X的化学式是_____、Y的化学式是_____、Z的名称是_____。
(2)由Y和Z组成,且Y和Z质量比为7:20的化合物的化学式(分子式)是_____。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的一种阳离子是_____。
(4)由X、Y、Z元素按原子个数比为4:2:3组成的化合物,该化合物的化学式(分子式)是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。已知200 ℃时:
反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ/mol
反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8 kJ/mol
下列说法不正确的是( )
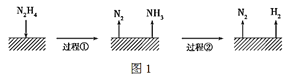
A.图1所示过程①是放热反应,②是吸热反应
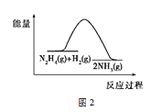
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为:N2H4(g)= N2(g)+2H2(g) ΔH=-50.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,请回答下列问题:
(1)金红石(TiO2)是钛的主要矿物之一,基态Ti原子价层电子的排布图为_________,基态O原子电子占据最高能级的电子云轮廓图为 __________形。
(2)以TiO2为原料可制得TiCl4,TiCl4的熔、沸点分别为205K、409K,均高于结构与其相似的CCl4,主要原因是 __________________。
(3)TiCl4可溶于浓盐酸得H2[TiCl6],向溶液中加入NH4Cl浓溶液可析出黄色的(NH4)2[TiCl6]晶体。该晶体中微观粒子之间的作用力有 ________。
A.离子键 B.共价键 C.分子间作用力 D.氢键 E.范德华力
(4)TiCl4可与CH3CH2OH、HCHO、CH3OCH3等有机小分子形成加合物。上述三种小分子中C原子的VSEPR模型不同于其他分子的是 _____,该分子中C的轨道杂化类型为________ 。
(5)TiO2与BaCO3一起熔融可制得钛酸钡。
①BaCO3中阴离子的立体构型为 ________。
②经X射线分析鉴定,钛酸钡的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),则钛酸钡的化学式为 _________。已知晶胞边长为a pm,O2-的半径为b pm,则Ti4+、Ba2+的半径分别为____________pm、___________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用环己醇制备环己酮,使用的氧化剂可以是次氯酸钠、重铬酸钾等。

已知:环己醇沸点:160.8℃,微溶于水;
环己酮沸点:155.6℃,微溶于水;
醋酸沸点117.9℃,和水以任意比例互溶。
下列装置分别是产品的合成装置和精制装置示意图:
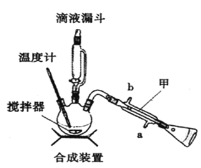
合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2mL环己醇和25mL冰醋酸。开动搅拌器,将40mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5min。然后,在室温下继续搅拌30min后,在合成装置中再加入30mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。回答下列问题:
(1)在合成装置中,甲装置的名称是_____________。
(2)三颈烧瓶的容量为_____________(填“50mL"、“100mL”或“250mL")。
(3)滴液漏斗具有特殊的结构,主要目的是_____________。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是_____________。然后加入精制食盐使之变成饱和溶液,将混合液倒入_____________中,分离得到有机层。
(5)用如图对粗产品进行精制,蒸馏收集_____________℃的馏分。
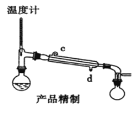
(6)检验环己酮是否纯净,可使用的试剂为_____________。
A.重铬酸钾溶液B.金属钠C.新制的氢氧化铜悬浊液D.醋酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com