
 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
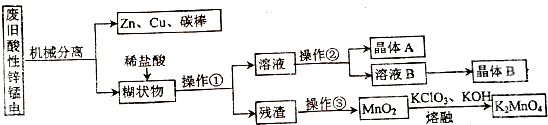
分析 (1)原电池的正极应是氧化剂发生还原反应,根据原电池的总反应Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH可知正极反应式;
(2)废电池经机械分离后,糊状物主要为MnO2、MnOOH、NH4Cl、碳粉、Zn(NH3)2Cl2等.加稀盐酸溶解得到氯化铵和氯化锌溶液,过滤得残渣主要为MnO2、MnOOH、碳粉,残渣在空气中灼烧碳被氧化成二氧化碳,MnOOH被氧化成二氧化锰,二氧化锰在碱性高温的条件下被氯酸钾氧化成锰酸钾,根据氯化铵和氯化锌的溶解度可知,混合溶液经浓缩后过滤可得晶体A为NH4Cl,再将滤液蒸发结晶可得晶体B为氯化锌,据此答题;
(3)根据(2)中的分析可知操作③的名称;
(4)根据流程可知,二氧化锰在碱性高温的条件下被氯酸钾氧化成锰酸钾,据此书写化学方程式;
(5)锌皮含有少量杂质铁,溶于稀硫酸和双氧水,得硫酸锌和硫酸铁混合溶液,调节pH值使铁刚好完全沉淀,锌不沉淀,过滤除去铁,再调节pH值使锌生成氢氧化锌沉淀,将氢氧化锌溶于硫酸得硫酸锌溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnSO4•7H2O,据此答题;
解答 解:(1)原电池的正极应是氧化剂发生还原反应,根据原电池的总反应Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH可知正极反应式为MnO2+e-+NH4+=MnOOH+NH3,
故答案为:MnO2+e-+NH4+=MnOOH+NH3;
(2)废电池经机械分离后,糊状物主要为MnO2、MnOOH、NH4Cl、碳粉、Zn(NH3)2Cl2等.加稀盐酸溶解得到氯化铵和氯化锌溶液,过滤得残渣主要为MnO2、MnOOH、碳粉,残渣在空气中灼烧碳被氧化成二氧化碳,MnOOH被氧化成二氧化锰,二氧化锰在碱性高温的条件下被氯酸钾氧化成锰酸钾,根据氯化铵和氯化锌的溶解度可知,混合溶液经浓缩后过滤可得晶体A为NH4Cl,再将滤液蒸发结晶可得晶体B为氯化锌,
故答案为:NH4Cl;
(3)根据(2)中的分析可知操作③的名称为在空气中灼烧,
故答案为:在空气中灼烧;
(4)根据流程可知,二氧化锰在碱性高温的条件下被氯酸钾氧化成锰酸钾,反应的化学方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O,
故答案为:3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O;
(5)锌皮含有少量杂质铁,溶于稀硫酸和双氧水,得硫酸锌和硫酸铁混合溶液,调节pH值使铁刚好完全沉淀,锌不沉淀,过滤除去铁,再调节pH值使锌生成氢氧化锌沉淀,将氢氧化锌溶于硫酸得硫酸锌溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnSO4•7H2O,
①加入H2O2氧化亚铁离子,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②根据Fe(OH)3的Ksp可知,铁离子沉淀完全时,溶液中c(OH-)=$\root{3}{\frac{10{\;}^{-39}}{1{0}^{-5}}}$=1×10-11 mol/L,所以溶液的pH值为3,使铁刚好完全沉淀,
故答案为:3;
③硫酸锌溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnSO4•7H2O,晶体用冷水洗涤的原因是降低晶体的溶解度,减少损失,
故答案为:蒸发浓缩、冷却结晶;降低晶体的溶解度,减少损失.
点评 本题考查物质制备分离、阅读题目获取信息能力、化学方程式及离子方程式书写、化学计算等,需要学生具备扎实的基础及迁移运用能力,难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )| A. | 该硫酸的物质的量浓度为18.4 mol/L | |
| B. | 1 mol Zn与足量的该硫酸反应,产生22.4 L氢气 | |
| C. | 配制20 mL 4.6 mol/L的稀硫酸需用量筒取该硫酸5.00 mL | |
| D. | 该硫酸与等体积的水混合后所得溶液的物质的量浓度等于9.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在2Al+2NaOH+2H2O═2NaAlO2+3H2反应中,水和氢氧化钠均作氧化剂 | |
| B. | Al分别于盐酸和氢氧化钠溶液反应,生成等质量的H2,转移的电子数相同 | |
| C. | CO2与Na2O2反应中,每生成1molO2,转移4mol电子 | |
| D. | 在Cu2S+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+S↓+SO2↑+4H2O反应中,被氧化的元素只有硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | pH=1的溶液中:K+、Cr2O72-、CH3CH2OH、SO42- | |
| D. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ba2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期非金属元素氧化物水化物的酸性从左到右依次增强 | |
| B. | 水加热到很高的温度都难以分解是因为水分子间存在氢键 | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素的种类由核内质子数决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉能漂白是因为Ca(ClO)2在一定条件下能生成HClO | |
| B. | 氢氧化铝、小苏打等可用于治疗胃酸过多 | |
| C. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| D. | 二氧化硅可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 加热碳酸氢钠固体时使试管竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 实验室制取少量的氯气,在通风橱内进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 试剂 | 分离方法 |
| A | Cl2(水蒸气) | 生石灰 | 洗气 |
| B | KCl溶液(K2SO4) | 适量Ba(NO3)2溶液 | 过滤 |
| C | NaCl固体(KNO3) | 蒸馏水 | 冷却结晶 |
| D | 花生油(水) | - | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应阶段 | I | II | III |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
| 解释 | CO32-+H+=HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com