
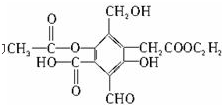
分析 有机物含有酯基,可发生水解反应,含有酚羟基,可与氢氧化钠反应,含有羧基,具有酸性,可发生中和、酯化反应,以此解答该题.
解答 解:(1)能与NaOH反应的官能团有酯基、羧基和酚羟基,且1个酯基可水解生成乙酸和酚羟基,都能与NaOH反应,则A与参加反应的NaOH的物质的量之比为1:4,
故答案为:1:4;
(2)-COOH、-CHO与新制Cu(OH)2完全反应,1mol-COOH消耗0.5molCu(OH)2,1mol-CHO消耗2molCu(OH)2,被氧化生成的-COOH继续反应,只有与醛的反应为还原反应,则A与被还原的Cu(OH)2的物质的量之比为1:2,故答案为:1:2;1:2;
(3)能与碳酸氢钠反应的官能团只有羧基,A与参加反应的NaHCO3物质的量之比为1:1,故答案为:1:1.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团的性质为解答的关键,注意结构与性质的关系即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X>Y,则酸性:HA>HB | |
| B. | 若X=Y,则HB一定是强酸 | |
| C. | 若酸性:HA<HB,则X和Y关系不确定 | |
| D. | 若由水电离出的H+的浓度:(I)>(Ⅱ),则是X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其所含有的官能团有(写结构简式)-$\underset{\stackrel{\;}{C}}{|}=O$、-OH、C=C、-O-.
,其所含有的官能团有(写结构简式)-$\underset{\stackrel{\;}{C}}{|}=O$、-OH、C=C、-O-. .这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果.L-多巴分子中所含的官能团的名称是羟基、氨基和羧基.
.这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果.L-多巴分子中所含的官能团的名称是羟基、氨基和羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是实验室制备SO2并验证SO2某些性质的装置图.
如图是实验室制备SO2并验证SO2某些性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对空气进行降温加压 | B. | 金刚石变成石墨 | ||
| C. | NaCl熔化 | D. | 碘溶于CCl4中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com