
分析 质子数相同中子数不同的同一元素的不同原子互称同位素,同位素必须原子;
同一元素形成的不同单质称同素异形体,同素异形体必须是单质;
结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物;
分子式相同结构不同的化合物互称同分异构体;
同种物质指组成和结构都相同的物质;根据定义分析判断.
解答 解:①O2和O3均是氧元素形成的不同种单质,互称为同素异形体;
②金刚石和石墨均是碳元素形成的不同种单质,互为同素异形体;
③35Cl和37Cl都是氯元素的不同原子,所以是同位素;
④CH3CH2CH2CH3和CH3CH2CH3结构相似,在分子组成上相差1个CH2原子团,互称为同系物;
⑤CH3CH2CH2CH2CH3和CH3CH(CH3)CH2CH3,分子式相同,结构不同,属于同分异构体;
⑥(CH3)2C(CH3)2和C(CH3)4分子式相同,结构相同,属于同一物质;
故答案为:③;①②;④;⑤;⑥.
点评 本题主要考查了同系物、同分异构体、同位素、同素异形体、同一物质的区别,难度不大,注意把握概念的内涵与外延.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
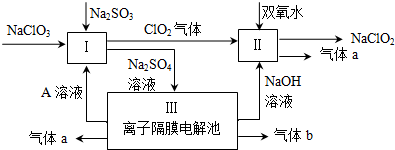
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 稀有气体原子的最外层电子数都是8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
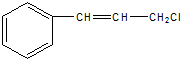 中官能团的名称:碳碳双键、氯原子.
中官能团的名称:碳碳双键、氯原子.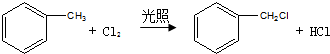 .
.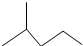 所表示物质的名称是:2-甲基戊烷.
所表示物质的名称是:2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| B | C |
| D |
| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | A、D、E均可形成两种常见氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴 加酚酞. | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色.与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞.镁带用砂纸打磨后与2mol/L盐酸反应. | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
| 探究同一周期从左到右元素 金属性的递变规律 | 探究同一主族内从上到下元素 非金属性的递变规律 | |||||||
| Ⅰ | ||||||||
| Ⅱ | ||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2XO3 | B. | HXO3 | C. | H3XO4 | D. | H2XO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数d>c>b>a | B. | 离子半径C2->D->B+>A2+ | ||
| C. | 原子半径A>B>C>D | D. | 非金属性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数A>B>C>D | B. | 原子半径D>C>A>B | ||
| C. | 氢化物的稳定性H2D>HC | D. | 碱性的强弱AOH>B(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com