


科目:高中化学 来源: 题型:
| A、放出无色无味的气体,生成大量白色沉淀 |
| B、放出无色无味的气体,生成白色沉淀后恰好溶解 |
| C、放出无色无味的气体,生成白色沉淀后部分溶解 |
| D、无任何现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种途径所消耗的铜的物质的量相等 |
| B、三种途径所消耗的硝酸的物质的量相等 |
| C、所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2) |
| D、所消耗的硝酸的物质的量是:途径(1)>途径(3)>途径(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
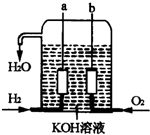 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | 原子的电子层数与未成对电子数相同,其单质气体在所有的气体中最轻 |
| B | 基态原子核外电子占据三种能量不同的轨道,且每种轨道中的电子总数相同 |
| D | 原子的核外电子总数是最内层电子总数的4倍 |
| E | 有“生物金属”之称,E4+和氩原子的核外电子排布相同 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com