
分析 (1)草木灰中的钾盐可以溶于水中形成溶液,可以利用过滤的方法来获得钾盐的水溶液,加热蒸发可得到晶体;
(2)根据天平平衡的原理,把样品放在右盘,砝码放在左盘,若指针偏向右边,则右边重;
(3)玻璃棒可用于搅拌、引流等作用.
解答 解:(1)草木灰中的钾盐可以溶于水中形成溶液,然后利用过滤的方法可以获得钾盐的水溶液,将所得的水溶液蒸发结晶可以获得氯化钾的固体,
故答案为:过滤;蒸发滤液;
(2)用托盘天平称量样品时,若指针偏向右边,则表示左盘轻、砝码重,
故答案为:B;
(3)在溶解固体时,使用玻璃棒可以加速溶解;在过滤操作中,可以用玻璃棒来引流,防止滤液溅到漏斗外;在蒸发结晶操作中,用玻璃棒来搅拌,使溶液受热均匀,防止滤液飞溅;
故答案为:搅拌,加速样品溶解;引流,防止滤液溅到漏斗外;搅拌,使溶液受热均匀,防止滤液飞溅.
点评 本题考查混合物的分离提纯,把握粗盐提纯实验及离子的检验为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
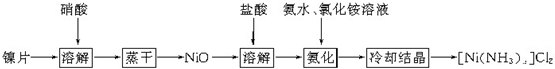
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
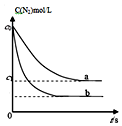 汽车尾气中,产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气中,产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | 若曲线b对应的条件改变是温度,可判断该反应的△H<0 | |
| B. | 温度T下,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 温度T下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{c}_{1}^{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O$\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Cl2+H2O═HC1+HC1O | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
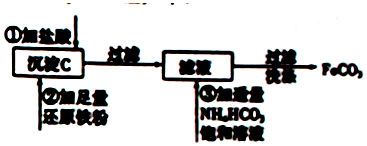
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
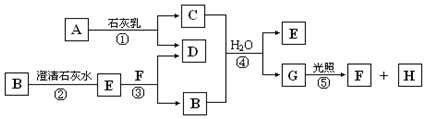 图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).
图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在轮船水线以下的船体装上一定数量的锌块 | |
| B. | 在金属表面进行电镀 | |
| C. | 在一定条件下对金属进行处理,在其表面形成一层致密的氧化膜 | |
| D. | 将铁闸门与直流电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
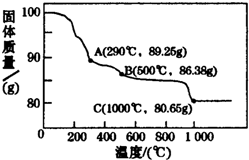 钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com