
| A. | 1 mol OH-中含有9NA个电子 | |
| B. | 28 g CO气体中含有NA个氧原子 | |
| C. | 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA |
分析 A.1个氢氧根离子含有10个电子;
B.依据n=$\frac{m}{M}$计算物质的量结合分子式计算氧原子数;
C.溶液体积未知;
D.常温常压下Vm≠22.4L/mol;
解答 解:A.1个氢氧根离子含有10个电子,1 mol OH-中含有9NA个电子,故A错误;
B.28g的CO气体物质的量为1mol,分子中含有NA个氧原子,故B正确;
C.溶液体积未知,无法计算铝离子个数,故C错误;
D.常温常压下Vm≠22.4L/mol,无法计算甲烷的物质的量,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是微粒结构分析计算,盐类水解的应用,明确以物质的量为核心的计算公式、熟悉气体摩尔体积使用条件是解题关键,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gN2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4 L N2含有的分子数目为NA | |
| C. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 改变条件 | 平衡移动方向 | pH | 水电离出的c(H+) | KW |
| 升温 | ||||
| 通入HCl气体 | ||||
| 加入NaOH固体 | ||||
| 加入NH4Cl固体 | ||||
| 加入金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
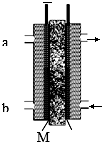 甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3 | (1)在白色浑浊物中加入过量盐酸,会变澄清 |
假设2 | (2)白色浑浊物是BaSO4,主要 原因是Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 | 反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊; (3)通入纯净的CO2的目的防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 g氖气所含原子数为6.02×1023 | |
| B. | 25℃时,pH=6的水溶液中c(H+)>c(OH-) | |
| C. | 实验室制氢气时加入少量CuSO4可加快反应速率是利用了盐类的水解 | |
| D. | 把16.0 g无水硫酸铜粉末放在足量饱和硫酸铜溶液中会析出25.0 g晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com