
| A. | H2SO4的摩尔质量是98g | |
| B. | 标况下,H2的摩尔体积是22.4L | |
| C. | 将1mol NaCl溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L | |
| D. | 氧气的摩尔质量与它的相对分子质量在数值上相等 |
分析 A、根据摩尔质量的单位进行判断;
B、气体摩尔体积的单位是L/mol;
C、解于500mL水中所得溶液体积并不是500ml,溶解的过程中体积要发生变化,应该是配制成500ml溶液;
D、摩尔质量与它的相对分子质量在数值上相等.
解答 解:A、H2SO4的摩尔质量应该是98g/mol,故A错误;
B、气体摩尔体积的单位是L/mol,所以H2的摩尔体积是22.4L/mol,故B错误;
C、解于500mL水中所得溶液体积并不是500ml,溶解的过程中体积要发生变化,应该是配制成500ml溶液,故C错误;
D、摩尔质量与它的相对分子质量在数值上相等,所以氧气的摩尔质量与它的相对分子质量在数值上相等,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的分析判断,物质的量浓度、摩尔质量、气体摩尔体积等几个概念分析应用,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:解答题
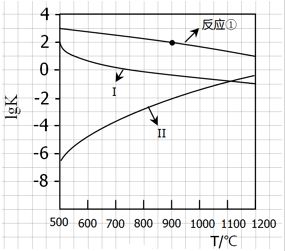 用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.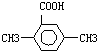 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
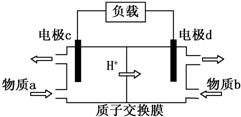
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g钠在氧气中完全燃烧失电子数为0.5NA | |
| B. | 标准状况下,22.4 L苯所含的分子数 | |
| C. | 室温下,8 g甲烷含有共价键数为2NA | |
| D. | 1 L 1 mol•L-1硫酸溶液所含的H+数 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 78g由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA | |
| B. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| C. | 将1mol FeCl3水解制成胶体,所得胶体中含有的胶体粒子数NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 纯铁的硬度和强度均高于铁合金 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 一定条件下,铁粉可与水蒸气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
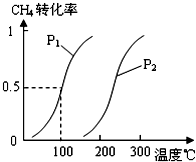 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①②,用CH4和H2O为原料来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验方案 | 现象 | 结论 |
| A | 加入盐酸 | 产生无色气体 | 含铝、铁、镁三种元素 |
| B | 加入NaOH溶液 | 产生无色气体 | 含有铝元素 |
| C | 加盐酸溶解后,再加入少量NaOH溶液 | 产生白色沉淀 | 含有镁元素 |
| D | 加盐酸溶解后,再滴加KSCN溶液 | 溶液呈血红色 | 含有铁元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com