
分析 (1)根据Fe(OH)3胶体的制备过程进行判断;
(2)根据胶体与溶液性质的区别进行解答.
解答 解:(1)Fe(OH)3胶体的制备过程:向煮沸的蒸馏水中逐滴加入FeCl3饱和溶液;继续煮沸至溶液呈红褐色,FeCl3+3H2O(沸水)$\frac{\underline{\;加热\;}}{\;}$Fe(OH)3(胶体)+3HCl,停止加热,可制得Fe(OH)3胶体,
故答案为:饱和FeCl3;溶液呈红褐色;FeCl3+3H2O(沸水)$\frac{\underline{\;加热\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(2)胶体具有丁达尔效应,据此可以区分胶体和溶液,胶体的丁达尔效应是胶体粒子对光线的散射作用形成的,
故答案为:丁达尔效应.
点评 本题考查了胶体的制备及性质,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握,题目难度不大.注意掌握胶体的制备方法、胶体的性质及鉴别方法.


科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | 9.3 | 3.7 | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、W元素的原子半径依次递增 | |
| B. | X、Z、W元素的最高价氧化物的水化物的酸性依次递增 | |
| C. | X、W分别与Y形成化合物在常温下均为气态 | |
| D. | Z、W分别与Y形成的化合物均可作为耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )
Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )| A. | ① | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
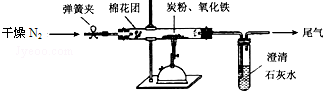
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 已知图Ⅱ△H<0,由图Ⅱ知,t3时采取的措施是降低反应体系温度 | |
| C. | 由图Ⅱ知,反应在t6时,NH3体积分数最大 | |
| D. | Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出5.16kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量铁片放入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 大理石与稀盐酸反应:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| D. | 氢氧化钙溶液中通入过量CO2:OH-+CO2═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g水中所含的电子数为8NA | |
| B. | 常温常压下,28g氮气所含的原子数为2NA | |
| C. | 0.5molCuO的摩尔质量为40g/mol | |
| D. | 22.4L甲烷(CH4)所含的原子数为5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com