
����Ŀ��ʵ���Ҳ���MgCl2��AlCl3�Ļ����Һ�������ˮ��Ӧ�Ʊ�MgAl2O4 �� ��Ҫ�������£� 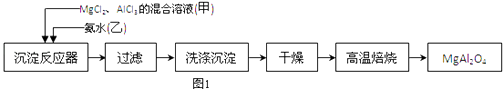
��1��ΪʹMg2+��Al3+ͬʱ���ɳ�����Ӧ���������Ӧ���м�������ס����ҡ������ٵμ���һ��Ӧ�
��2������ͼ��ʾ�����˲����е�һ�������� �� 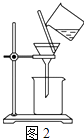
��3���ж������г����Ƿ�ϴ�����õ��Լ��� �� ���±���ʱ������ʢ�Ź�������������� ��
��4����ˮAlCl3��183������������ʪ��������������������ʵ���ҿ�������װ���Ʊ��� 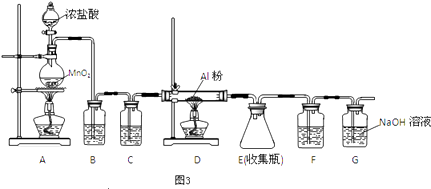
װ��B��ʢ�ű���NaCl��Һ����װ�õ���Ҫ������ �� F���Լ��������� �� ��һ������װ���ʵ��Լ���Ҳ����F��G�����ã���װ����Լ�Ϊ ��
���𰸡�
��1����
��2��©���¶˼���δ�����ձ��ڱ�
��3��AgNO3��Һ���������ữ��AgNO3��Һ��������
��4����ȥHCl������ˮ��������ʯ��
���������⣺��1�����ȼ���MgCl2��AlCl3�Ļ����Һ���ټӰ�ˮ����ˮ������Ӧ������������þ��������֮���ȼӰ�ˮ����ˮ��������ͬʱ���ɳ��������Դ��ǣ��ң���2������ʱӦ�ý�©���ļ��첿�ֽ����ձ����ڱڣ���ֹҺ�彦�������Դ��ǣ�©���¶˼���δ�����ձ��ڱڣ���3��������Ӧ�ø��������Ӻ�笠����ӣ����ж��Ƿ�ϴ��������ȡ�������һ��ϴ��Һ������AgNO3��Һ���������ữ��AgNO3��Һ����Һ�����жϣ������ɰ�ɫ��������˵��û��ϴ�Ӹɾ�����û�г������ɣ���˵���Ѿ�ϴ�Ӹɾ������±��չ���Ӧ�������н��У� ���Դ��ǣ�AgNO3��Һ���������ữ��AgNO3��Һ������������4��B�еı���ʳ��ˮ��Ϊ�˳�ȥ���е�HCl���壻��Ϊ�Ȼ�������ˮ�⣬��Ӧ�÷�ֹ�����е�ˮ��������Eװ�ã���G�����շ�Ӧʣ������������Կ��Լ����ʯ��������F��G�����ã�
���Դ��ǣ���ȥHCl������ˮ��������ʯ�ң�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2��g��+B2��g���T2AB��g���������仯��ͼ��ʾ���ж�������������ȷ���ǣ� �� 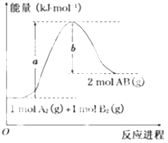
A.ÿ����2����AB����b kJ����
B.����1mol A��A��1mol B��B�����ų�a kJ����
C.�÷�Ӧ�з�Ӧ��������������������������
D.�÷�Ӧ�ȡ�H=+��a��b��kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڣ��ҹ�������ҵΥ�����۵��µ���ˮ������Ⱦ�ֳ�Ϊý�役�㣮��ˮ����������кܶ�ָ�꣬����ˮ���ܽ�����DO���Ķ����Ǻ���ˮ���Ծ�������һ��ָ�꣮�� �����ܽ�����DO���IJⶨ�����ǣ� ����һ���¶�����ȡ100.00mL����ˮ�����ڼ���������ʹ���е�O2��Mn2+����ΪMnO��OH��2��
2Mn2++O2+4OH���T2MnO��OH��2
������ٷ�Ӧ�����Һ�м���KI��Һ��ʹ�������ɵ�MnO��OH��2�ٻ�ԭ��Mn2+��
MnO��OH��2+2I��+4H+�TMn2��+I2+3H2O
�������0.0100molL��1 Na2S2O3����Һ�ζ�����������ɵ�I2��I2+2S2O32���TS4O62��+2I�� �� ����Na2S2O3����Һ11.00mL��
��1�������ʹ�õ�ָʾ���ǵ�����Һ���ζ��յ�ʱָʾ������ɫ�仯����� ��
��2��������ᣨH2S2O3����һ�ֶ�Ԫ���ᣮ�����Ӧѡ���ζ��ܽ��еζ���������ӷ���ʽ˵��ԭ�� ��
��3��ˮ�����ܽ�����DO����Ũ��ΪmgL��1 ��
��4���� ����ʵ������Na2S2O3��������100mL 0.0100molL��1 Na2S2O3����Һ���밴���ƵĹ�����дѡ��������˳�������ţ��� �ٲ����� �ڽ�ͷ�ι� ��100mL����ƿ ����ƽ ��25mL�ձ�
��5������0.0100molL��1 Na2S2O3����Һʱ�����в���ʹ������ҺŨ��ƫ�ߵ��� ��
A.û��������ˮϴ���ձ�
B.����ʱ��������ƿ�̶���
C.����ǰ����ƿϴ����û����
D.ҡ�Ⱥ��Һ���½����ټ�ˮ���̶���
E.����ƽ����ҩƷʱ�����̵ͣ����̸ߣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������5�ֻ����е�2����ͬ����������ϣ��γɵ��л�������NaOH��Ӧ���У� �� ��-OH ��-CH3�۩�COOH ��-CHO ��-C6H5 ��
A.2��
B.3��
C.4��
D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֱ����뷴Ӧ����ʽ��Ӧ����ȷ���ǣ� ��
A.�Ҵ����廯���ˮ��Һ���ȣ�CH3CH2OH+HBr��CH3CH2Br+H2O
B.����������ڹ��������µķ�Ӧ��2CH4+Cl2 ![]() 2CH3Cl+H2
2CH3Cl+H2
C.������Һ�е���NaOH��Һ��H++OH����H2O
D.��������Һ��ͨ������CO2��CO2+H2O+2C6H5O����2C6H5OH+2CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������÷�Һ©�����з���Ļ������( )
A. ���Ȼ�̼��ˮB. �ƾ�������C. ������Ȼ�̼D. ���ͺ�ֲ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaAlH4���⻯���ƣ��ͻ����������Ҫ�Ļ�ԭ����һ�������£��ɽ����ƺ�H2��Ӧ���ɼף�����ˮ��Ӧ�ɲ���H2 �� ����AlCl3��Ӧ�ɵõ�NaAlH4 �� ��4.80g��������ȫ�ֽ⣬�õ������ƺ�2.24L��������ɱ�״������H2 �� ���ƲⲢ�ش�
��1��NaAlH4����Ԫ�صĻ��ϼ����Ļ�ѧʽΪ ��
��2������AlCl3��Ӧ�õ�NaAlH4�Ļ�ѧ����ʽ ��
��3��NaAlH4�����ᷴӦ�Ļ�ѧ����ʽΪ ��
��4��������ˮ�����¿���ΪijЩ������Ʒ�������������ijɷֱ�ʾΪFe2O3����������̷�����Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ֱ���������ϡ���������������Һ��Ӧ��������ȫ�ܽ�ʱ����Ӧ�����ĵ�HCl��NaOH���ʵ���֮��Ϊ
A. 1��1B. 2��1C. 1��2D. 3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ڹ��ۻ�������ǣ� ��
A. ������B. ����C. ����D. ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com