
| A. | 78% | B. | 22% | C. | 14% | D. | 13% |
分析 由C3H7OH改写为C3H6.H2O,C2H5OC2H5改写为C4H8.H2O,而C3H6、C4H8、C6H12的最简式为CH2,原混合物可知CH2与H2O混合物,根据氧元素质量分数计算H2O的质量分数,进而计算CH2的质量分数,再结合最简式CH2计算碳元素质量分数,w(H)=1-w(O)-w(C),据此计算.
解答 解:由C3H7OH改写为C3H6.H2O,C2H5OC2H5改写为C4H8.H2O,而C3H6、C4H8、C6H12的最简式为CH2,原混合物可知CH2与H2O混合物,混合物中氧的质量分数为8%,则H2O的质量分数为$\frac{8%}{\frac{16}{18}}$=9%,故CH2的质量分数为1-9%=91%,碳元素质量分数为91%×$\frac{12}{14}$=78%,故混合物中w(H)=1-w(O)-w(C)=1-9%-78%=14%,故选C.
点评 本题考查混合物中质量分数计算,侧重考查学生分析计算能力,关键是利用化学式改写将三组分混合物转化为两组分混合物,并出现元素质量定比关系,难度中等.


科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2水溶液能导电,所以SO2是电解质 | |
| B. | NaCl溶液能导电所以NaCl溶液是电解质 | |
| C. | 向醋酸溶液中加入少量氢氧化钠固体,溶液的导电能力降低 | |
| D. | Na2CO3既是钠盐又是碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①离子晶体②分子晶体③分子晶体④金属晶体 | |
| B. | ①原子晶体②分子晶体③分子晶体④金属晶体 | |
| C. | ①离子晶体②分子晶体③金属晶体④金属晶体 | |
| D. | ①原子晶体②离子晶体③分子晶体④分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
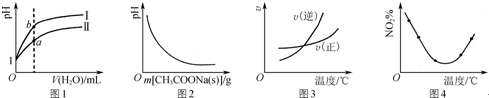
| A. | 图1表示相同温度下,相同体积、pH均为1的盐酸和醋酸溶液分别加水稀释时溶液pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2表示CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化 | |
| C. | 图3表示某可逆反应正、逆反应速率随温度变化,则该反应的正反应是吸热反应 | |
| D. | 图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)???N2O4(g),相同时间后测得NO2体积分数的曲线,则该反应的正反应△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com