
【题目】能使湿润的蓝色石蕊试纸变红的气体是
A. CH4B. NH3C. SO2D. O3
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】钨主要用于制造硬质或耐高温的合金。自然界中黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。黑钨矿冶炼钨的工艺流程如下:
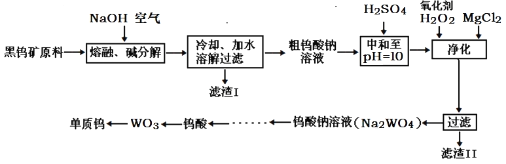
已知:①滤渣I的主要成份是Fe2O3、MnO2;
②上述流程中,除最后一步外,其余步骤中钨的化合价未变;
③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为__________,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式____________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,“净化”过程中,加入H2O2的目的是__________,滤渣Ⅱ的主要成分是__________。
(3)高温下密闭容器中用H2还原WO3可得到金属钨,其反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表。
温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
主要成分 | WO3 W2O5 WO2 W |
已知:温度过高时,WO2(s)可转变为WO2(g)。
WO2(s)+2H2(g) ![]() W(s)+2H2O(g) △H =+66.0 kJ·mol-1
W(s)+2H2O(g) △H =+66.0 kJ·mol-1
WO2(s) ![]() WO2(g) △H =+203.9 kJ·mol-1
WO2(g) △H =+203.9 kJ·mol-1
则在700℃时,WO2(g)与H2(g)反应生成固体W(s)的热化学方程式为_____________。
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶性的电解质,两者的溶解度均随温度升高而减小。不同温度下两种物质的沉淀溶解平衡曲线如右图,则T1时Ksp(CaWO4) =________。
在钨酸钠溶液中加入石灰乳得到大量钨酸钙,则T2时该反应的平衡常数为________。
(5)利用电解法可以从碳化钨(WC)废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,盐酸为电解液,阳极析出钨酸并放出CO2,该阳极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生物金属”之称。下列有关![]() Ti和
Ti和![]() Ti的说法中,正确的是( )
Ti的说法中,正确的是( )
A. ![]() Ti和
Ti和![]() Ti是中子数不同质子数相同的同种核素
Ti是中子数不同质子数相同的同种核素
B. 分别由![]() Ti和
Ti和![]() Ti组成的金属钛单质互称为同分异构体
Ti组成的金属钛单质互称为同分异构体
C. ![]() Ti和
Ti和![]() Ti互为同素异形体
Ti互为同素异形体
D. ![]() Ti和
Ti和![]() Ti原子的核外电子排布相同
Ti原子的核外电子排布相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E都是有机化合物,A为一取代芳香烃,B中含有一个甲基。它们的转化关系如下:

请回答下列问题:
(1) A 的名称为_____________;
(2)由B生成C的化学方程式为_______________________________;
(3)由B生成D、由C生成D的反应条件分别是________、 ________ 。
(4)由A生成B、由D生成E的反应类型分别是________、 ________ 。
(5)在E的同分异构体中,苯环上一硝化的产物只有一种的共有___种,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是_____(填结构简式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)填写下表空格中,物质类别所对应的官能团名称或结构简式
物质类别 | 烯烃 | 酚 | 醛 | 羧酸 |
官能团名称 | 碳碳双键 | ___________ | 醛基 | ___________ |
结构简式 | ___________ | –OH | ___________ | ___________ |
(2) 的名称为______________。
的名称为______________。
(3)![]() 的名称为_____________________。
的名称为_____________________。
(4)2,4,6-三硝基甲苯(TNT)的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的.主要步骤如下:
下列说法不正确的是( )
A. 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳
B. 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤
C. 加入试剂②反应的离子方程式为:OH﹣+H+=H2O
D. 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)下列描述能说明该可逆反应达到化学平衡状态的有 。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3 mol H-H键断裂,有6 mol N-H键形成
D.消耗0.1molN2的同时消耗0.2molNH3
(2)若起始时向容器中充入10 mol·L-1 的N2和15 mol·L-1的H2 ,10 min时测得容器内NH3的浓度为1.5mol·L-1。
列式计算:
①10min内N2表示的反应速率;
②此时H2的转化率。(转化率是指某时刻某物质已经转化的量与该物质起始量之比)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。

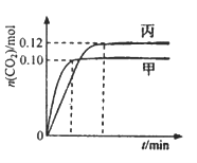
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率小于50%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸是生活中常见的有机物。关于乙醇和乙酸的说法不正确的是
A. 两者互为同分异构体B. 沸点都比C2 H6的沸点高
C. 两者之间能发生酯化反应D. 两者均是某些调味品的主要成分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com