
| A. | 等温等压条件下,5 mol O2(g)和2 mol H2(g)的体积之比等于5:2 | |
| B. | 等温等压下,SO2气体与CO2气体的密度之比等于16:11 | |
| C. | 温度和容积相同的两气罐中分别盛有5 mol O2(g)和2 mol N2(g),压强之比等于5:2 | |
| D. | 温度相同、体积相同的O2(g)和N2(g)分子数相同 |
分析 A.等温等压下,气体的Vm相同,气体的物质的量与体积呈正比;
B.等温等压下,气体的Vm相同,结合ρ=$\frac{nM}{n{V}_{m}}$=$\frac{M}{{V}_{m}}$判断;
C.温度和容积相同的气体,容器的压强与气体的物质的量呈正比;
D.压强不一定相同,则Vm不一定相同,体积相同时,物质的量不一定相同.
解答 解:A.等温等压下,气体的Vm相同,气体的物质的量与体积呈正比,5molO2(g)和2molH2(g)的体积之比等于5:2,故A正确;
B.等温等压下,气体的Vm相同,由ρ=$\frac{nM}{n{V}_{m}}$=$\frac{M}{{V}_{m}}$可知SO2气体与CO2气体的密度之比等于64:44=16:11,故B正确;
C..温度和容积相同的气体,容器的压强与气体的物质的量呈正比,则两容积中的压强之比等于5:2,故C正确;
D.压强不一定相同,则Vm不一定相同,体积相同时,物质的量不一定相同,二者分子数不一定相等,故D错误.
故选D.
点评 本题考查阿伏伽德罗定律及其应用,为高频考点,侧重于学生的分析能力的考查,注意把握气体存在的条件以及相关计算公式的运用,难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 因为NaHSO4是电解质,因此固体NaHSO4能够导电 | |
| B. | NaHSO4固体中阳离子和阴离子的个数比是2:1 | |
| C. | NaHSO4固体熔化时破坏的是离子键和共价键 | |
| D. | NaHSO4固体溶于水时既破坏离子键又破坏共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 纯盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
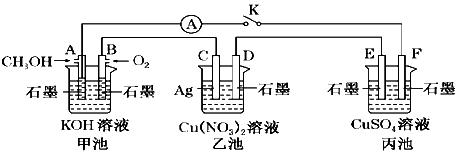
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
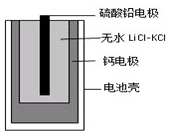 热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.
热激活电池可用作火箭、导弹的工作电池.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb.| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,Li+向钙电极移动 | |
| C. | 外电路中,电子由硫酸铅电极经导线流向钙电极 | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g石墨烯(单层石墨)中含C原子个数为NA | |
| B. | 等质量的C18O与NO含有的原子个数均为2NA | |
| C. | 1.0L 1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| D. | 25℃时1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性(酸性溶液):HCl>CoCl2>HI | B. | 酸性(水溶液):CH3COOH>HCN>H2CO3 | ||
| C. | 热稳定性:KCl<KClO4<KClO | D. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com