
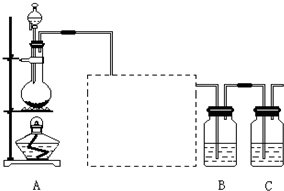
分析 (1)根据实验的目的可知要先获得氯气,需制取氯气的装置,进而确定装置中的物质和反应的原理方程式;
(2)二氧化锰和浓盐酸反应制得的氯气中含有氯化氢杂质,可以用饱和食盐水除去;
(3)证明氯气的氧化性强于硫单质的实验室氯气和硫化钠之间的反应,氧化性越强则原子的得电子能力强;
(4)判断原子的得电子能力强弱的方法:最高价氧化物对应水化物的酸的酸性强弱、离子的还原性强弱、氢化物的稳定性、将同样的金属氧化到的价态等;
(5)用氢氧化钠对氯气进行尾气处理.
解答 解:根据题意,验证氯元素的非金属性比硫元素的非金属性强的原理是氯气可以将硫从其化合物硫钠中置换出来.
(1)装置A的作用是制取氯气,分液漏斗中盛装的试剂是浓盐酸,反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:浓盐酸; MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)二氧化锰和浓盐酸反应制得的氯气中含有氯化氢杂质,可以用盛有饱和食盐水的洗气瓶将其除去,虚线框内的实验装置图为: ,
,
故答案为: ;饱和食盐水;除去Cl2中的HCl气体;
;饱和食盐水;除去Cl2中的HCl气体;
(3)氯气可以将硫从其化合物中置换出来的事实可以证明氯元素的非金属性比硫元素的非金属性强,反应的原理是:S2-+Cl2=2Cl-+S↓,有淡黄色沉淀生成,属于置换反应,故答案为:A;有淡黄色沉淀生成,S2-+Cl2=2Cl-+S↓;置换;
(4)最高价氧化物对应水化物的酸的酸性越强,则原子的得电子能力越强,故②正确,S2-比Cl-易被氧化,说明单质的氧化性是氯气强于硫,所以原子的得电子能力Cl强于S,故③正确,元素的氢化物的稳定性越强则原子的得电子能力越强,故④正确,单质将同样的金属氧化到的价态越高则原子的得电子能力强,故⑥正确,硫原子与氯原子电子层数相同,同周期元素的原子半径越小,得电子能力越强,故⑦正确,故选B,
故答案为:B;
(5)实验时,用氢氧化钠对氯气进行尾气处理,反应的原理方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O.
点评 本题考查学生分析和解决问题的能力,要求学生具备熟练的基本知识功底,难度较大.


科目:高中化学 来源: 题型:解答题
 $→_{△}^{H_{2}SO_{4}.SO_{3}(发烟硫酸)}$
$→_{△}^{H_{2}SO_{4}.SO_{3}(发烟硫酸)}$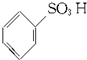
 $\stackrel{Fe,HCl,H_{2}O}{→}$
$\stackrel{Fe,HCl,H_{2}O}{→}$
 $\stackrel{NaClO}{→}$
$\stackrel{NaClO}{→}$

 C
C D
D .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除储气罐上空泄漏出的高浓度氯气,可喷洒碱液 | |
| B. | 发生氯气泄漏时,附近人员可用浸有碳酸钠溶液的毛巾捂住鼻孔进行自我保护 | |
| C. | 氯气能腐蚀金属及非金属材料,这种腐蚀主要属于电化学腐蚀 | |
| D. | 三氯化氮分子是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ①⑥ | C. | ②④⑧ | D. | ③⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{84}^{210}$Po与${\;}_{84}^{209}$Po互为同素异形体 | |
| B. | ${\;}_{84}^{210}$Po与${\;}_{84}^{209}$At互为同位素 | |
| C. | ${\;}_{84}^{210}$Po与${\;}_{84}^{209}$Po在元素周期表中占有相同的位置 | |
| D. | 钋元素的相对原子质量为210 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 239Pu原子的原子核中含有239个质子 | |
| B. | 238Pu、239Pu和241Pu属于不同的核素 | |
| C. | 238Pu与238U在元素周期表中的位置相同 | |
| D. | 239Pu衰变成235U属于化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com