
| A.热稳定性:HF > HCl > HBr > HI |
| B.微粒的半径:Cl-> Na+> Mg2+> Al3+ |
| C.电离程度(同温度同浓度溶液中):HCl > CH3COOH > NaHCO3 |
| D.分散质粒子的直径:Fe(OH)3悬浊液 > Fe(OH)3胶体 > FeCl3溶液 |
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
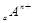 、
、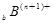 、
、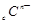 、
、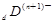 电子层结构相同。关于A、B、C、D四种元素叙述正确的是
电子层结构相同。关于A、B、C、D四种元素叙述正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由X与Y组成的化合物的沸点总低于由X与Z组成的化合物的沸点 |
| B.元素Z、W 的简单离子的电子层结构不同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.因为水溶液的酸性:HCl>H2S,所以非金属性:Cl>S |
| B.同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1 |
| C.元素原子的最外层电子数越多,越容易得电子,非金属性越强 |
| D.同周期主族元素的原子形成的简单离子电子层结构相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
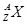 和
和 两种粒子,下列叙述正确的是
两种粒子,下列叙述正确的是 | A.质子数相等 |
| B.X元素的质量数为A |
C. 一定具有稀有气体元素原子的核外电子排布 一定具有稀有气体元素原子的核外电子排布 |
| D.它们的化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com