
【题目】由ⅢA、VA族元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。与BCl3互为等电子体,且由第二周期元素组成的一种阴离子为__________(填离子符号)。
(2)氨硼烷(H3N—BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料。
①H3N—BH3中N原子的轨道杂化类型为________________。
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数为____________;BH4-的立体构型是_______;该制备反应的化学方程式为______________。
(3)氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
下列有关叙述错误的是_____________
A.氨硼烷中存在配位键
B.第一电离能大小关系:N>O>C>B>H
C.反应前后碳原子的杂化类型不变
D.CH4、H2O、CO2分子空间构型分别是:正四面体型、V型、直线型
(3)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为_____________。Ga的配位原子(As)数目为________;Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGacm和rAscm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为__________。

【答案】 CO32-或NO3- sp3 1 正四面体 TiCl3+3LiBH4=Ti(BH4)3+3LiCl C 原子晶体 4 ![]()
【解析】试题分析:(1)根据等电子体理论,原子数相同、价电子数也相同的粒子是等电子体;(2) ①H3N—BH3中N 原子价电子对数是(5+3)÷2=4;②基态Ti3+的核外电子排布式为1s22s22p63s23p63d1;BH4-中N 原子价电子对数是(3+4+1)÷2=4;Ti(BH4)3由TiCl3和LiBH4反应制得; B一般形成3个共价键;同周期元素从左到右第一电离能逐渐增大,ⅡA族、ⅤA 族大于相邻的元素;由Ti(BH4)3中H显负价,H的第一电离能大于B;CH4、CO2中C原子的杂化方式分别是SP3和SP;根据价电子互斥理论分析CH4、H2O、CO2分子空间构型;(4) 根据GaAs的熔点为1238℃判断晶体的类型。根据晶胞结构分析Ga的配位原子(As)数;晶胞中实际原子的体积除以晶胞的体积=晶胞中原子的体积占晶胞体积的百分率。
解析:(1)根据等电子体理论,原子数相同、价电子数也相同的粒子是等电子体,所以与BCl3互为等电子体,且由第二周期元素组成的一种阴离子为CO32-或NO3-;(2) ①H3N—BH3中N 原子价电子对数是(5+3)÷2=4,N原子的轨道杂化类型为sp3;②基态Ti3+的核外电子排布式为1s22s22p63s23p63d1,未成对电子数为1;BH4-中N 原子价电子对数是(3+4+1)÷2=4,没有孤对电子,BH4-的立体构型是正四面体;Ti(BH4)3由TiCl3和LiBH4反应制得,方程式为TiCl3+3LiBH4=Ti(BH4)3+3LiCl;(3) B一般形成3个共价键,其中1个是配位键,故A正确;同周期元素从左到右第一电离能逐渐增大,ⅡA族、ⅤA 族大于相邻的元素,故B正确;CH4、CO2中C原子的杂化方式分别是SP3和SP,故C错误;根据价电子互斥理论分析CH4中C原子价电子对数是(4+4)÷2=4,没有孤对电子,CH4是正四面体;H2O中O原子价电子对数是(6+2)÷2=4,有孤对电子,H2O是折线型;、CO2中C原子价电子对数是4÷2=2,没有孤对电子,CO2分子空间构型是直线,故D正确; (4) GaAs的熔点高,所以晶体的类型原子晶体。根据晶胞结构,离Ga的最近的As原子数为4;根据均摊原则,1个晶胞含有4个Ga原子和4个As原子,根据密度为ρg·cm-3,1个晶胞的体积为1÷〔ρ÷(4MGa+4MAs)×NA〕;4个Ga原子和4个As原子的总体积为16π (rGa3+rAs3)÷3;晶胞中原子的体积占晶胞体积的百分率![]() 。
。


科目:高中化学 来源: 题型:
【题目】Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性。可用作医药、抗氧化剂以及制备次磷酸钠等。由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:

步骤1.在三口烧瓶中加入白磷和石灰乳,先通入N2,然后在约98°C下充分搅拌1h,同时收集产生的PH3。
步骤2.将反应液静置、过滤。
步骤3.向滤液中通入适量CO2,再过滤。
步骤4.用次磷酸溶液调节步骤3滤液的pH,浓缩、冷却结晶、干燥得次磷酸钙。
(1)步骤1先通入N2的目的是 ;搅拌的目的是 。
(2)步骤1石灰乳与 P4(白磷)发生反应的化学方程式为 ;步骤2过滤所得滤渣成分为 。
(3)步骤3的目的是 。
(4)请补充完整由产品进一步制备NaH2PO2·H2O的实验方案:取产品次磷酸钙加入烧杯中,加适量的水溶解, ,干燥得到NaH2PO2·H2O。(已知:在常压下,加热蒸发次磷酸钠溶液会发生爆炸,100℃时NaH2PO2·H2O的溶解度为667g/100g水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为 ,其中氮的化合价为 。
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 。
(3)①2O2(g)+N2(g)==N2O4(l) △H1
②N2(g)+2H2(g)==N2H4(l) △H2
③O2(g)+2H2(g)==2H2O(g) △H3
④2N2H4(l)+N2O4(l)==3N2(g)+4H2O(g) △H4=-1048.9kJ-mol-1
上述反应热效应之间的关系式为△H4= ,联氨和N2O4可作为火箭推进剂的主要原因为 。
(4)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为 (已知:N2H4+H+![]() N2H5+的K=8.7xl07; Kw=1.0xl0-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7xl07; Kw=1.0xl0-14)。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2 kg;与使用Na2S03处理水中溶解的O2相比,联氨的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3,3-二苯基丙酸是一种医药中间体,某科技活动小组拟设计如下合成路线制备:
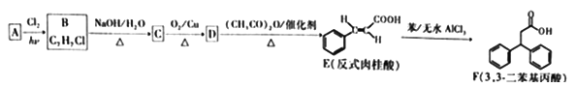
回答下列问题:
(1)A的名称为____________;B→C、E→F的反应类型分別为_________、________;参照E的结构和名称,反式对羟基肉桂醛的结构简式为_____________;F的分子式为_______________。
(2)C→D的化学方程式为_____________;D与(CH3CO)2O在催化剂作用下反应生成E,另一种产物的结构简式为______________。
(3)E的芳香族同分异构体中,含有碳碳双键,能与FeCl3溶液发生显色反应,还能发生银镜反应的共有_____________种(不含立体异构)。
(4)参照上述合成路线,以D、![]() 、苯为原料(无机试剂任选),设计制备
、苯为原料(无机试剂任选),设计制备 的合成路
的合成路
线______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是利用一种微生物将废水中的尿素【CO(NH2)2】的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是

A. N为正极,铁电极应与Y相连接
B. M电极反应式: CO(NH2)2+H2O-6e- = CO2↑+N2↑+6H+
C. 当N电极消耗0.25 mol气体时,则铁电极增重16 g
D. H十透过质子交换膜由右向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 白磷和红磷互为同素异形体,两者之间不能相互转化
B. C2H6和C5H12一定互为同系物
C. CH3CH2CH(CH3)2的名称是3-甲基丁烷
D. CH3OCHO和HCOOCH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,2.24LCCl4含有的共价键数为0.42NA
B. 氢原子数为0.4NA的甲醇分子中含有的键数为0.4NA
C. 1![]() Fe溶于过量硝酸,电子转移数为2NA
Fe溶于过量硝酸,电子转移数为2NA
D. 14![]() 乙烯和丙烯混合气体中的氢原子数为2NA
乙烯和丙烯混合气体中的氢原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满。回答下列问题:
(1)B、C中第一电离能较大的是______________(填元素符号),基态D原子价电子的轨道表达式为______________。
(2)DA2分子的VSEPR模型是______________。H2A比H2D熔沸点高得多的原因是______________。

(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______________晶体(填晶体类型),其中C原子的杂化轨道类型为______________杂化。
②[C(OH)4]-中存在的化学键有______________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是__________。

(5)B、C的氟化物晶格能分别是2957kJ·mol-1、5492kJ·mol-1,二者相差很大的原因是______________。
(6)D与E所形成化合物晶体的晶胞如右图所示。
①在该晶胞中,E的配位数为____________。
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(![]() ,0,
,0,![]() );c为(
);c为(![]() ,
,![]() ,0)。则d原子(面心上)的坐标参数为______________。
,0)。则d原子(面心上)的坐标参数为______________。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为______________pm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com