
分析 (1)Cu作催化剂,NH3、F2反应生成NF3、NH4F;
(2)由反应物NF3+和H2O和生成物HF、NO 和 HNO3书写方程式;
(3)NO易与空气中氧气反应生成红棕色的NO2气体,同时生成的HF和HNO3易结合空气中的水蒸气形成酸雾,有刺激性气味;
(4)NF3与H2O反应产生HF、NO 和 HNO3,HF、NO 和 HNO3和NaOH反应生成NaNO3、NaF、NaNO2;
解答 解:(1)Cu作催化剂,NH3、F2反应生成NF3、NH4F,反应方程式为4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F,该反应中1mol氨气化合价升高作还原剂,3mol氟气化合价降低作氧化剂,所以氧化剂与还原剂的物质的量之比为3:1;故答案为:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F;3:1;
(2)由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,故答案为:3NF3+5H2O=2NO+HNO3+9HF;
(3)NO易与空气中氧气反应生成红棕色的NO2气体,同时生成的HF和HNO3易结合空气中的水蒸气形成酸雾,有刺激性气味,
故答案为:产生红棕色气体,产生刺激性气味气体,产生白雾;
(4)NF3与H2O反应产生HF、NO 和 HNO3,HF、NO 和 HNO3和NaOH反应生成NaNO3、NaF、NaNO2,故答案为:NaNO3、NaF、NaNO2;
点评 本题考查含氮化合物的性质以及氧化还原反应,题目难度中等,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaHSO4 | C. | NaHCO3 | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
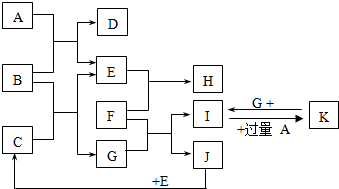 如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质.
如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.
,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25 mL量筒量取12.36 mL盐酸 | B. | 托盘天平称取8.75克食盐 | ||
| C. | 用酸式滴定管量取4.90mL硫酸 | D. | 用广泛pH试纸测得某溶液pH为3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L (NH4)2SO4溶液中:c(SO42-)<c(NH4+) | |
| B. | 相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH-)之比是2:1 | |
| C. | 向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3-) | |
| D. | 常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)和(6) | B. | (3)和(4) | C. | (2)和(5) | D. | (1)和(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2<H2O<SiO2<KCl | B. | 还原性:S2->I->Br->Cl- | ||
| C. | 酸性:H3PO4>H2SO4>HClO4>H2SiO3 | D. | 稳定性:H2O<NH3<PH3<SiH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com