
下列四种基本类型的反应中,一定是氧化还原反应的是
A.分解反应 B.置换反应 C.复分解反应 D.化合反应
科目:高中化学 来源:2014-2015学年广东省江门市高三3月模拟考试理科综合化学试卷(解析版) 题型:选择题
有机物在生活中的应用非常广泛。下列有关说法正确的是
A.食用植物油均可水解生成氨基酸
B.铺路用的沥青主要含有C、H、O等元素
C.做衣服的棉、麻的主要成分是纤维素
D.煤经过汽化、液化等物理变化可转化为清洁燃料
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省七市教科研协作体高三3月联考化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)为一种黄绿色气体,是一种高效、广谱、安全的杀菌、消毒剂。制备ClO2的方法有多种。
(1)纤维素还原法制ClO2。其原理是:纤维素水解得到的最终产物A与NaClO3反应生成ClO2。完成反应的化学方程式:其流程如下:□ (A) +□NaClO3+□H2SO4=□ClO2↑+□CO2↑+□H2O+□______
(2)电解食盐水制取ClO2 ,其流程如下:
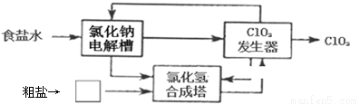
①粗盐中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中加入试剂的顺序依次为__________(填化学式),充分反应后将沉淀一并滤去,再加入盐酸。
②食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸在发生器中反应生成ClO2 ,写出发生器中生成ClO2的化学方程式____________________。
③上述流程中,可循环利用的物质有__________;按照绿色化学原则,电解槽阴极产生的气体与方框中物质的物质的量之比为________时,原子的利用率为100%。
(3)实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:
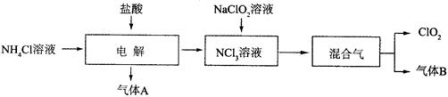
已知:(I)A气体在标准状况下的密度为0.089g/L;
(Ⅱ)气体B能使湿润的红色石蕊试纸变蓝。
①电解时,发生反应的化学方程式为 。
②NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
在KClO3+6HCl=3Cl2↑+ KCl +3H2O中,有30 mole-转移,生成的氯气在标准状况下的体积为
A.22.4L B.336.0L C.403.2L D.672.0L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
密度为1.84g/cm3,浓度为98%的浓H2SO4的物质的量的浓度为
A.18.4mol/L B.9.2mol/L C.13mol/L D.12mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:实验题
(14分)海波(Na2S2O3·5H2O)常用手纺织和造纸工业,海波是无色透明的晶体,易溶于水,遇酸立即分【解析】
S2O32— + 2H+ === S↓+ SO2↑+ H2O。
硫化碱法是工业上制备海波的方法之一,反应原理为:2Na2S+Na2CO3+4SO2 === 3Na2S2O3+CO2
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O,实验装置如下图所示:
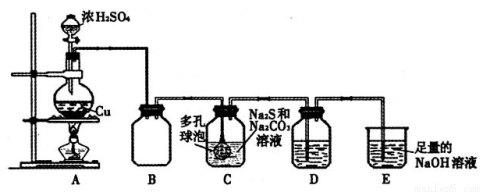
(1)装置A中滴加浓硫酸的仪器名称是 ,发生反应的化学方程式是 ,实验室还可以用A装置制取的气体单质有 (填化学式)。
(2)装置C中连接多孔球泡可以提高S O2的吸收效率,其依据的原理是 。
(3)装置D的作用是检验装置C中SO2的吸收效率,D中的试剂可以是 。
a.品红溶液 b.氢氧化钠溶液
c.酚酞溶液 d.酸性高锰酸钾溶液
(4)装置E的作用是 。
(5)实验制得的Na2S2O3·5H2O产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3·5H2O产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论: 。
(6)Na2S2O3溶液是定量实验中的常用试剂,为了测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量的稀H2SO4,滴加指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,3次平行实验测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7) = mol·L-1。(已知:Cr2O72— +6I— +14H+ === 2Cr3+ +3I2 +7H2O,2S2O32— + I2===S4O62—+2 I—)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
下列相关工业制法的描述不正确的是
A.电解熔融氯化钠制取金属钠
B.电解熔融的Al(OH) 3制取金属铝
C.用石英、纯碱、石灰石为原料制玻璃
D.用焦炭在电炉中还原二氧化硅得到含杂质的粗硅
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:填空题
(6分)分析下列反应:3S+6 KOH = 2K2S+K2SO3+3H2O,据此作答:
(1)用双线桥标出该反应中电子的转移方向和数目:3S +6 KOH = 2K2S+K2SO3+3H2O
(2)该反应的氧化产物是 。
(3)该反应的氧化剂与还原剂的质量比是 。
(4)当消耗0.3 mol S时,则转移的电子数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com