
| 实验要求 | 实验方法 |
| 测定某工业废水的酸碱度 | |
| 检验自来水中残余氯分子 | |
| 检验CO2气体中含有的SO2 | |
| 除去FeCl2中的少量FeCl3 | |
| 除去NO中混有的少量NO2 |
分析 溶液的酸碱性不同,其pH不同,可以通过检测溶液的pH判断溶液酸碱性;
氯气具有强氧化性,能氧化碘离子生成碘,碘遇淀粉试液变蓝色;
二氧化硫具有漂白性,二氧化碳没有漂白性;
氯化铁和Fe能发生氧化还原反应生成氯化亚铁;
二氧化氮和水反应生成硝酸和NO,且NO不易溶于水.
解答 解:溶液的酸碱性不同,其pH不同,可以通过检测溶液的pH判断溶液酸碱性,所以可以将样品滴在PH试纸上
比较溶于的pH大小,从而确定溶于酸碱性;
氯气具有强氧化性,能氧化碘离子生成碘,碘遇淀粉试液变蓝色,所以可以用湿润的淀粉碘化钾试纸检验氯分子;
二氧化硫具有漂白性,二氧化碳没有漂白性,所以可以用品红溶液检验二氧化硫;
氯化铁和Fe能发生氧化还原反应生成氯化亚铁,所以可以用Fe粉除去氯化亚铁中的氯化铁然后过滤;
二氧化氮和水反应生成硝酸和NO,且NO不易溶于水,所以可以用水洗然后干燥的方法除去NO中的二氧化氮,
故答案为:
| 实验要求 | 实验方法 |
| 测定某工业废水的酸碱度 | C |
| 检验自来水中残余氯分子 | E |
| 检验CO2气体中含有的SO2 | A |
| 除去FeCl2中的少量FeCl3 | B |
| 除去NO中混有的少量NO2 | D |
点评 本题较综合,涉及溶液酸碱性判断、物质判断、除杂等知识点,侧重考查学生知识运用能力,明确元素化合物性质及性质差异性是解本题关键,注意除杂时要除去杂质且不能引进新的杂质,且操作简便.


科目:高中化学 来源: 题型:选择题
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-Q+23.5)kJ•mol-1 | |
| B. | CxHy(l)+( x+$\frac{y}{4}$)O2═xCO2+$\frac{y}{2}$H2O(l)△H=?-$\frac{9Q}{10}$?kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=-$\frac{9Q}{10}$ kJ•mol-1 | |
| D. | CxHy(l)+( x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+2.61)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
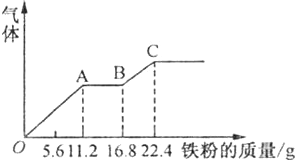
| A. | 图中,AB段的反应为Fe+2Fe 3+=3Fe 2+,溶液中溶质最终为FeSO 4 | |
| B. | 原溶液中H2SO4浓度为2.5mol•L -1 | |
| C. | 原混合溶液中NO3-的物质的量为0.4mol | |
| D. | 图中,OA段产生的气体是NO,BC段产生的气体是氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
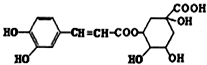
| A. | 分子中所有碳原子可能共面 | |
| B. | 一定条件下,1mol该物质最多与4molNaOH反应 | |
| C. | 水解产物都可以与FeCl3溶液发生显色反应 | |
| D. | 1mol该物质最多与6mol Br2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1.5 mo1•L-1NaCl溶液 | B. | 75 mL 3 mol•L-1MgCl2溶液 | ||
| C. | 150 mL 2 mo1•L-1KCl溶液 | D. | 75 mL 1 mol•L-1A1C13溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
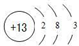 ;B和C形成的化合物的电子式为
;B和C形成的化合物的电子式为 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com