
| ||
| ||
| 1000mol×22.4L/mol |
| 89.6×103L |


科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A | B | C | D | |
| 甲 | 乙烯 | 甲烷 | 乙炔(C2H2) | 乙烷 |
| 乙 | 环己烷(C6H12) | 苯 | 苯 | 乙醇 |
| A.A、 | B.B、 | C.C、 | D.D、 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HNO3是氧化剂,NO2是还原产物 |
| B.若2mol HNO3被还原,则反应中一定生成22.4L NO2气体 |
| C.参加反应的硝酸中,被还原和未被还原硝酸的物质的量比是1:1 |
| D.硝酸在反应中既表现了强氧化性,又表现了酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
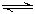 CH3COO-+H+。对于该平衡,下列叙述正确的是( )。
CH3COO-+H+。对于该平衡,下列叙述正确的是( )。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com