
| A. | 浓度均为0.1 mol•L-1的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③<②<① | |
| B. | 工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2,随着SO2的吸收,吸收液的pH不断变化.当吸收液呈酸性时:c (Na+)=c (SO32-)+c (HSO3-)+c (H2SO3) | |
| C. | 常温下,将0.1 mol•L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍 | |
| D. | 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
分析 A.①(NH4)2CO3溶液中的碳酸根离子和铵根离子相互促进水解,导致铵根离子浓度减小;②(NH4)2SO4溶液铵根离子正常水解;③(NH4)2Fe(SO4)2溶液中的亚铁离子水解溶液显示酸性,铵根离子水解溶液显示酸性,亚铁离子的水解抑制了铵根离子水解;
B.吸收液脱除烟气中的SO2,随着SO2的吸收,吸收液的pH不断变化.当吸收液呈酸性时,可能是亚硫酸氢钠或亚硫酸氢钠和少量亚硫酸钠:
C.比值$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{c({H}^{+})}$,据此计算判断;
D.向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液得到等浓度的碳酸钠和碳酸氢钠混合溶液;
解答 解:A.(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液,(NH4)2CO3溶液中CO32-离子促进NH4+水解,(NH4)2Fe (SO4)2溶液中Fe2+抑制NH4+离子水解,
则同浓度的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,铵根离子浓度大小为:(NH4)2Fe (SO4)2>(NH4)2SO4>(NH4)2CO3,③>②>①,故A错误;
B.工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2,随着SO2的吸收,吸收液的pH不断变化.当吸收液呈酸性时,可能是亚硫酸氢钠或亚硫酸氢钠和少量亚硫酸钠,c (Na+)=c (SO32-)+c (HSO3-)+c (H2SO3)是碳酸氢钠溶液中的物料守恒,故B错误;
C.常温下,将0.1 mol•L-1 CH3COOH溶液加水稀释,溶液中电离平衡常数不变,比值$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{c({H}^{+})}$,当溶液的pH从3.0升到5.0时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍,故C正确;
D.向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液得到等浓度的碳酸钠和碳酸氢钠混合溶液,碳酸根离子水解程度大于碳酸氢根离子,溶液中c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小、酸碱反应后溶液酸碱性的判断、弱电解质电离平衡的影响因素、电解质溶液中物料守恒和电荷守恒等,掌握基础是解题关键,题目难度中等.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:填空题
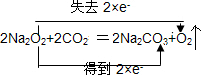 .
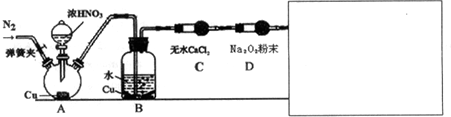
.
| 实验学生 | 实验操作 | 现象与结论 |
| 甲 | 滴入浓硝酸前,需先打开弹簧夹,通入一段时间N2,目的是将装置中的空气排出.关闭弹簧夹,打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 酸性高锰酸钾溶液不褪色,说明Na2O2能完全吸收NO, |
| 乙 | 去掉装置B,直接将A、C装置相连.打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
| 丙 | 在乙同学装置的基础上,将A装置中浓硝酸换成浓硫酸,并进行加热,(或将分液漏斗中的试剂换为浓硫酸,将铜换为亚硫酸钠粉末),打开分液漏斗活塞,加入适量试剂后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
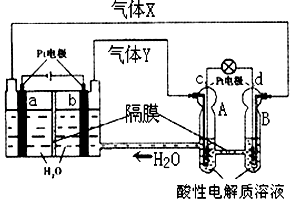 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | c极上进行还原反应,B中的H+可以通过隔膜进入A | |
| B. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| C. | 该装置开始工作后,右端装置能量变化为:电能→化学能 | |
| D. | 当有0.2mol电子转移时,a极产生1.12L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
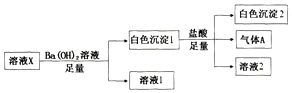 某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同.为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如图实验:下列说法正确的是( )
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同.为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如图实验:下列说法正确的是( )| A. | 气体A可能是CO2或SO2 | |
| B. | 溶液X中一定存在SO42-、HCO3-、Na+、Mg2+ | |
| C. | 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+ | |
| D. | 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 将SO2通入紫色石蕊溶液中 | 证明SO2具有漂白性 |
| B | 取两支试管,分别加入4mlL0.01mol•L-1KMnO4溶液,然后向另一支试管中加入0.1mol•L-1H2C2O4溶液2mL,向另一支试管中加入0.1mol•L-1H2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| C | 向10mL0.2mol•L-1NaOH溶液中滴入2滴0.1mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的溶度积: Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向含酚酞的Na2SO3溶液中加入BaCl2溶液 | 证明Na2SO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 糖类、油脂、蛋白质均能发生水解 | |
| D. | 家用燃煤中适量的生石灰能有效减少二氧化硫的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物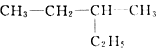 的名称是2-乙基丁烷 的名称是2-乙基丁烷 | |
| B. | 2-甲基丁烷和2,2-二甲基丙烷互为同系物 | |
| C. | 常温下,乙烯和苯都能被酸性KMnO4氧化,使KMnO4溶液褪色 | |
| D. | 等物质的量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | 仅①②③ | C. | 仅①③④ | D. | 仅②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3属于两性氧化物 | B. | 胆矾(CuSO4•5H2O)属于纯净物 | ||
| C. | NaHCO3属于强电解质 | D. | 纯碱属于碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com