
”¾ĢāÄæ”æ¶ĢÖÜĘŚŌŖĖŲW”¢X”¢Y”¢ZµÄŌ×ÓŠņŹżŅĄ“ĪŌö¼Ó£¬m”¢p”¢rŹĒÓÉÕāŠ©ŌŖĖŲ×é³ÉµÄ¶žŌŖ»ÆŗĻĪļ£¬nŹĒŌŖĖŲZµÄµ„ÖŹ£¬Ķس£ĪŖ»ĘĀĢÉ«ĘųĢ壬qµÄĖ®ČÜŅŗ¾ßÓŠĘư׊Ō£¬0.01mol/L rČÜŅŗµÄpHĪŖ2£¬pŹĒ¼×Ķ飬ÉĻŹöĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
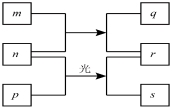
A£®XµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĪŖČõĖį
B£®ŌŖĖŲµÄ·Ē½šŹōŠŌZ£¾X£¾Y
C£®YµÄĒā»ÆĪļ³£ĪĀ³£Ń¹ĻĀĪŖĘųĢ¬
D£®Ō×Ó°ė¾¶µÄ“óŠ”W£¼X£¼Y
”¾“š°ø”æA
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ¶ĢÖÜĘŚŌŖĖŲW”¢X”¢Y”¢ZµÄŌ×ÓŠņŹżŅĄ“ĪŌö¼Ó£®m”¢p”¢rŹĒÓÉÕāŠ©ŌŖĖŲ×é³ÉµÄ¶žŌŖ»ÆŗĻĪļ£¬nŹĒŌŖĖŲZµÄµ„ÖŹ£¬Ķس£ĪŖ»ĘĀĢÉ«ĘųĢ壬ŌņnĪŖCl2£¬ZĪŖCl£¬ĀČĘųÓėpŌŚ¹āÕÕĢõ¼žĻĀÉś³ÉrÓės£¬0.01molL-1rČÜŅŗµÄpHĪŖ2£¬ŌņrĪŖHCl£¬sĶس£ŹĒÄŃČÜÓŚĖ®µÄ»ģŗĻĪļ£¬ŌņpĪŖCH4£¬ĀČĘųÓėm·“Ӧɜ³ÉHClÓėq£¬qµÄĖ®ČÜŅŗ¾ßÓŠĘư׊Ō£¬ŌņmĪŖH2O£¬qĪŖHClO£¬½įŗĻŌ×ÓŠņŹżæÉÖŖWĪŖHŌŖĖŲ£¬XĪŖCŌŖĖŲ£¬YĪŖOŌŖĖŲ”£A£®XµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļĪŖĢ¼Ėį£¬Ģ¼ĖįŹōÓŚČõĖį£¬¹ŹAÕżČ·£»B£®ĀȵÄŃõ»ÆĪļÖŠŃõŌŖĖŲ±ķĻÖøŗ»ÆŗĻ¼Ū£¬ŃõŌŖĖŲ·Ē½šŹōŠŌ±ČĀȵÄĒ棬øßĀČĖįĪŖĒæĖį£¬Ģ¼ĖįĪŖČõĖį£¬ĀČŌŖĖŲ·Ē½šŹōŠŌ±ČĢ¼µÄĒ棬¹Ź·Ē½šŹōŠŌY(O)£¾Z(Cl)£¾X(C)£¬¹ŹB“ķĪó£»C£®ŃõŌŖĖŲĒā»ÆĪļĪŖĖ®£¬³£ĪĀĻĀĪŖŅŗĢ¬£¬¹ŹC“ķĪó£»D£®ĖłŅŌŌŖĖŲÖŠHŌ×Ó°ė¾¶×īŠ”£¬Ķ¬ÖÜĘŚ×Ō×ó¶ųÓŅŌ×Ó°ė¾¶¼õŠ”£¬¹ŹŌ×Ó°ė¾¶W(H)£¼Y(O)£¼X(C)£¬¹ŹD“ķĪó£»¹ŹŃ”A”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹæÉŅŌ·¢Éś¶Ū»Æ·“Ó¦µÄŹĒ£Ø £©
A.FeŗĶÅØĮņĖį
B.FeŗĶÅØĻõĖį
C.AlŗĶÅØĮņĖį
D.AlŗĶÅØĻõĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃ”ŠŽ3”Ŗ”ŖĪļÖŹ½į¹¹ÓėŠŌÖŹ
ŅŃÖŖX”¢Y”¢Z”¢R”¢QĪŖÖÜĘŚ±ķÖŠŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄĒ°36ŗÅŌŖĖŲ£¬Ļą¹ŲŠÅĻ¢ČēĻĀ£ŗ
XŌŖĖŲŹĒÓīÖęÖŠ×ī·įø»µÄŌŖĖŲ |
YŌŖĖŲ»łĢ¬Ō×ÓµÄŗĖĶāpµē×ÓŹż±Čsµē×ÓŹżÉŁ1 |
ZŌŖĖŲ±»ÓžĪŖ”°Ģ«æÕ½šŹō”±£¬Ņ²ÓŠ”°ÉśĪļ½šŹō”±Ö®³Ę£¬Ę仳Ģ¬Ō×Ó“ĪĶā²ćÓŠ2øöĪ“³É¶Ōµē×Ó |
RŌŖĖŲŌŚŌŖĖŲÖÜĘŚ±ķµÄµŚŹ®Ņ»ĮŠ |
QŌŖĖŲŌŚÖÜĘŚ±ķĄļÓėRŌŖĖŲŌŚĶ¬Ņ»øö·ÖĒų |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)YX3ÖŠŠÄŌ×ÓµÄŌӻƹģµĄĄąŠĶŹĒ £¬Ąė×Ó»ÆŗĻĪļYX5µÄµē×ÓŹ½ŹĒ ”£
(2)COÓėY2ŹōÓŚµČµē×ÓĢ壬1 øöCO·Ö×ÓÖŠŗ¬ÓŠµÄ¦Š¼üŹżÄæŹĒ øö”£
(3)¹¤ŅµÉĻĄūÓĆZO2ŗĶĢ¼Ėį±µŌŚČŪȌדĢ¬ĻĀÖĘČ”»ÆŗĻĪļA(AæÉæ“×öŅ»ÖÖŗ¬ŃõĖįŃĪ)£¬A¾§ĢåµÄ¾§°ūĪŖÕż·½Ģå(ČēĶ¼1)”£
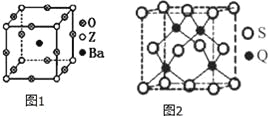
¢ŁÖʱøAµÄ»Æѧ·“Ó¦·½³ĢŹ½ŹĒ £»
¢ŚŌŚA¾§ĢåÖŠ£¬ZµÄÅäĪ»ŹżĪŖ £»
(4)R2+Ąė×ÓµÄĶāĪ§µē×Ó²ćµē×ÓÅŲ¼Ź½ĪŖ ”£R2OµÄČŪµć±ČR2SµÄ (Ģī”°øß”±»ņ”°µĶ”±)”£
(5)QŌŖĖŲŗĶĮņ(S)ŌŖĖŲÄܹ»ŠĪ³É»ÆŗĻĪļB£¬B¾§ĢåµÄ¾§°ūĪŖÕż·½Ģå(ČēĶ¼2)£¬Čō¾§°ūĄā³¤ĪŖ5.4”Į10-8cm£¬Ōņ¾§°ūĆܶČĪŖ gcm©3(ĮŠŹ½²¢¼ĘĖć)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖAĪŖŅ»ÖÖŃĪ£¬C”¢D”¢F”¢N”¢OĪŖĪŽÉ«ĘųĢ壬E³£ĪĀ³£Ń¹ĻĀĪŖĪŽÉ«ĪŽĪ¶µÄŅŗĢ壬N”¢H”¢LĪŖøßÖŠ³£¼ūµÄµ„ÖŹ£¬IĪŖ³£¼ūĪŽŃõĒæĖį£¬MµÄŃęÉ«·“Ó¦ĪŖ×ĻÉ«£¬·“Ó¦¢Ł³£ÓĆÓŚĘųĢåFµÄ¼ģŃ锣
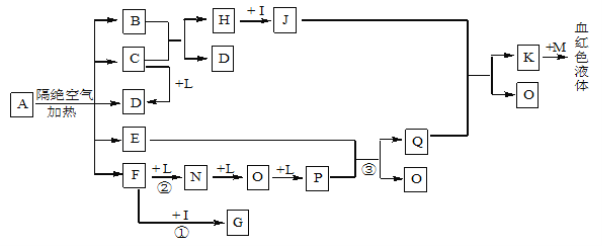
(1)Š“³öDµÄµē×ÓŹ½ĪŖ_______________£»
(2)Š“³ö·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½£ŗ £»Š“³ö·“Ó¦¢ŚµÄ»Æѧ·½³ĢŹ½£ŗ £»·“Ó¦¢ŪÖŠŃõ»Æ¼ĮŗĶ»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ_________________£»
(3)½«µČĢå»ż”¢µČÅØ¶ČµÄGŗĶFµÄČÜŅŗ»ģŗĻ£¬ČÜŅŗĻŌ¼īŠŌ£¬ŌņČÜŅŗÖŠĄė×ÓÅØ¶Č“Ó“óµ½Š”µÄĖ³ŠņĪŖ ______________________£»
(4)¼ģŃéJÖŠŃōĄė×ӵďµŃé·½·ØĪŖ £»
(5)ŅŃÖŖBÖŠŃõŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ22.2©£¬ĒŅA·Ö½ā²śÉśµÄø÷ĪļÖŹµÄĪļÖŹµÄĮæÖ®±ČĪŖn(B)£ŗn(C)£ŗ n(D)£ŗn(E)£ŗn(F)=1£ŗ2£ŗ2£ŗ1£ŗ2£¬ŌņAµÄ»ÆѧŹ½ĪŖ_________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČōÓĆŅŅĻ©ŗĶĀČĘųŌŚŹŹµ±µÄĢõ¼žĻĀ·“Ó¦ÖĘČ”ĖÄĀČŅŅĶ飬ÕāŅ»¹ż³ĢÖŠĖłŅŖ¾ĄśµÄ·“Ó¦¼°ŗÄÓĆĀČĘųµÄĮæŹĒ£ØÉčŅŅĻ©ĪŖ1mol £¬·“Ó¦²śĪļÖŠµÄÓŠ»śĪļÖ»ŹĒĖÄĀČŅŅĶ飩 £Ø £©
A. Č”“ś£¬4 mol Cl2 B£®¼Ó³É£¬2 mol Cl2
C£®¼Ó³É”¢Č”“ś£¬2 mol Cl2 D£®¼Ó³É”¢Č”“ś£¬3 mol Cl2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»ĆܱÕČŻĘ÷ÖŠŹ¢ÓŠH2ŗĶCl2»ģŗĻĘųĢåĢå»żĪŖn L£¬ÓƵē»š»ØŅżČ¼ŗ󣬻Öø“µ½ŌĄ“דĢ¬£¬ĘųĢåĢå»ż²»±ä”£°ŃĘųĢåĶØČė×ćĮæµÄNaOHČÜŅŗ£¬ĘųĢåƻӊŹ£Óą£¬ŌņŌ»ģŗĻĘųĢåÖŠH2ÓėCl2µÄĪļÖŹµÄĮæ±ČĪŖ£Ø £©:
A£®”Ż1 B£®”Ü1 C£®£½1 D£®£¼1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲĪļÖŹŠŌÖŹµÄĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.ČČĪČ¶ØŠŌ£ŗHCl£¼HBr£¼HI
B.Ō×Ó°ė¾¶£ŗK£¼Na£¼Li
C.ČŪµć£ŗCl2£¾Br2£¾I2
D.Ńõ»ÆŠŌ£ŗCl2£¾Br2£¾I2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĪĀ¶ČT1ŗĶT2Ź±£¬·Ö±š½«0.50 mol CH4ŗĶ1.2mol NO2³äČė1 LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ
CH4£Øg£©£«2NO2£Øg£©![]() N2£Øg£©£«CO2£Øg£©£«2H2O£Øg£©”÷H=akJ/mol”£²āµĆÓŠ¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
N2£Øg£©£«CO2£Øg£©£«2H2O£Øg£©”÷H=akJ/mol”£²āµĆÓŠ¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
ĪĀ¶Č | Ź±¼ä/min ĪļÖŹµÄĮæ | 0 | 10 | 20 | 40 | 50 |
T1 | n£ØCH4£©/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n£ØCH4£©/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®T1£¾T2£¬ĒŅa£¾0
B£®µ±ĪĀ¶ČĪŖT2”¢·“Ó¦½ųŠŠµ½40 minŹ±£¬ x£¾0.15
C£®ĪĀ¶ČĪŖT2Ź±£¬ČōĻņĘ½ŗāŗóµÄČŻĘ÷ÖŠŌŁ³äČė0.50 mol CH4ŗĶ1.2mol NO2£¬ÖŲŠĀ“ļµ½Ę½ŗāŹ±£¬n£ØN2£©=0.70mol
D£®ĪĀ¶ČĪŖT1Ź±£¬“ļĘ½ŗāŹ±CH4 µÄ×Ŗ»ÆĀŹ“óÓŚNO2µÄ×Ŗ»ÆĀŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲĪļÖŹÓ¦ÓƵĊšŹöÖŠ£¬ÕżČ·µÄŹĒ
A. SiO2ÓĆÓŚ°ėµ¼Ģå²ÄĮĻ B. Ć÷·ÆæÉŅŌÓĆÓŚ×ŌĄ“Ė®µÄɱ¾śĻū¶¾
C. ¹żŃõ»ÆÄĘæÉÓĆ×÷Ē±Ķ§¹©Ńõ¼Į D. ¹¤ŅµÉĻ²ÉÓƵē½ā±„ŗĶNaClČÜŅŗÖĘČ”Na
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com